【前沿资讯】CRISPRi筛选助力发现肿瘤免疫关键靶点

肿瘤免疫治疗是指应用免疫学原理和方法,通过激活体内的免疫细胞和增强机体抗肿瘤免疫应答,特异性地清除肿瘤微小残留病灶、抑制肿瘤生长,打破免疫耐受的治疗方法。肿瘤免疫治疗目的是克服肿瘤免疫逃逸的机制,重新唤醒免疫细胞清除癌细胞。由于其副作用小、治疗效果明显,正逐渐成为未来肿瘤治疗的发展方向,成为继手术、放疗和化疗之后的第四大肿瘤治疗技术。
今年五月,哈佛大学医学院的研究人员在Nature上发表题为Targetable leukaemia dependency on noncanonical PI3Kγ signalling的研究论文,影响因子64.8。PI3Kγ能够抑制肿瘤相关巨噬细胞刺激抗肿瘤免疫反应,是进行肿瘤免疫治疗的关键靶点,但PI3Kγ抑制剂的抗肿瘤杀伤作用并不理想。在本研究中研究人员使用CRISPR干扰(CRISPRi)筛选技术结合无偏的基因组范围筛选和功能性分析,在BPDCN细胞系中进行基因依赖性筛选,确定p21 (RAC1) 激活激酶1 (PAK1) 作为非典型磷脂酰肌醇3激酶γ(PI3Kγ)信号通路的一个非典型底物介导细胞内在的依赖性,有望通过PAK1抑制剂来抑制其磷酸化,减少对淋巴瘤中PI3Kγ抑制剂的耐药性,达到肿瘤免疫治疗的目的。

急性髓性白血病(AML)和急性淋巴细胞白血病(ALL)分别是成人和儿童最常见的急性白血病类型,而母浆细胞样树突状细胞肿瘤(BPDCN)是一种罕见的侵袭性血液系统恶性肿瘤,起源于浆细胞样树突状细胞(pDC)谱系,与AML和ALL具有相同的临床和病理特征。哺乳动物磷酸肌肽3-激酶(PI3K)家族包含8个亚型,其中I类PI3Ks分为IA类和IB类,产生3个磷酸肌醇脂来激活信号转导途径,而II类和III类PI3Ks是沿内吞途径的膜交通调节剂。Class IA PI3K有多种通路抑制剂被批准或正在开发中,而Class IB PI3K受到的关注较少,主要使用PI3Kγ抑制剂重新编程巨噬细胞,以进行实体肿瘤的免疫治疗。研究人员对CRISPR技术进行全基因组筛选和集成分析,定义了一种非典型的PI3Kγ信号通路的依赖性,这种依赖性被大多数BPDCNs和其他急性白血病(AMLs和ALLs)共享。研究发现PI3Kγ信号通过PIK3R5的激活和p21(RAC1)激活激酶1(PAK1)的磷酸化来驱动恶性表型,并且这种依赖性对PI3Kγ抑制敏感,为侵袭性白血病提供了新的治疗策略。
一、整合CRISPRi和生物信息学筛选揭示了白血病对PI3Kγ复合物的内在依赖性
研究人员利用BPDCN细胞系CAL-1进行全基因组CRISPRi依赖性筛选,测试了Dolcetto向导RNA 的A组和B组。在嘌呤霉素选择后的第0、14和21天采集样本,与阳性对照预期相符,第14和21天的最高依赖性属于核糖体蛋白和癌症依赖性图(DepMap)共同必需基因。在1335个显著的CAL-1依赖性中,研究人员将327个基因定义为核心依赖性,与第21天相比,其严格阈值为P < 0.001,倍增变化< 0.5。第21天的依赖关系中没有基因与DepMap的非必要阴性对照基因列表重叠,而327个核心依赖关系中的143个也是DepMap的常见要素,因此184个与共同必需列表不重叠的基因代表了潜在的特异性CAL-1/BPDCN依赖性。
此外,为了克服BPDCN细胞系缺乏的问题,研究人员在先前建立的类器官培养方案的基础上进行了修改,使BPDCN原发患者样本在体外保持至少两周的生存能力,开发了一种白血病适应性培养基(LAM),成功地从患者样本中建立了新的BPDCN细胞系。同时还测试了几种PI3K抑制剂,结果再次表明,PIK3R5/PIK3CG表达最高的三种白血病细胞系对选择性PI3Kγ抑制剂eganelisib具有很强的敏感性,表明PIK3R5/PIK3CG表达是PI3Kγ依赖性的特异性指标。
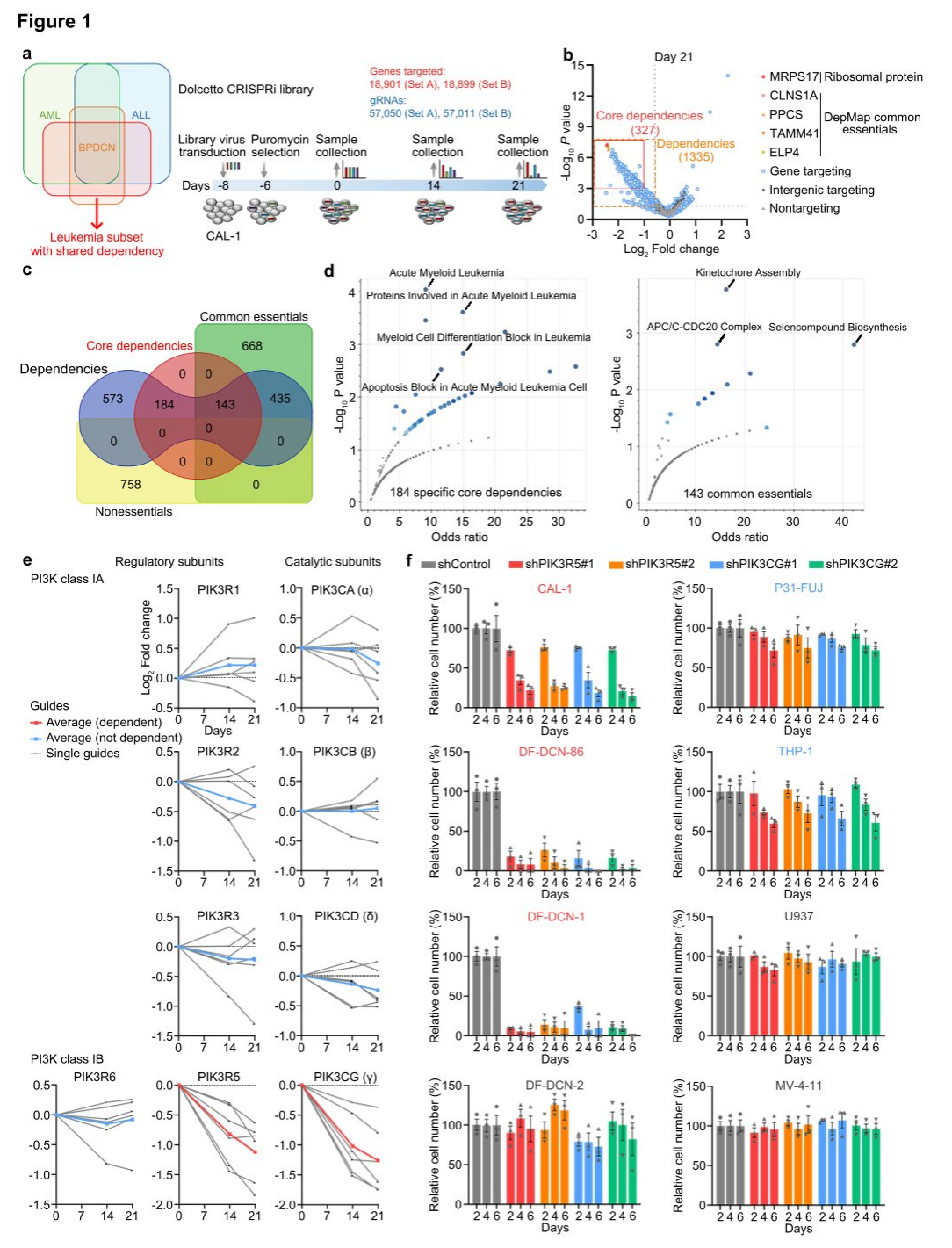
图1 全基因组CRISPRi筛选鉴定了BPDCN对PI3Kγ的选择性依赖性
二、PIK3R5表达与先天免疫应答信号(IIRS)相关,可被先天炎症信号激活
为了进一步确定PI3Kγ复合物依赖性,研究人员测试了AML、ALL和BPDCN PDX模型对PI3Kγ抑制的易损性。所有PIK3R5表达升高的白血病都对eganelisib敏感,而PIK3R5表达低的白血病则不敏感,表明白血病对PI3Kγ复合物的内在依赖性是各种病理亚型共有的,可以通过PIK3R5 mRNA表达水平来预测。
为了进一步阐明PIK3R5升高的白血病的特征,研究人员进行基因集富集分析(GSEA),比较了PIK3R5高和PIK3R5低的病例,结果显示所有顶部富集的基因集都与先天免疫反应途径相关。从分析中剔除BPDCN病例后,排除了BPDCN树突状细胞来源可能引起的潜在偏差,得出了相同的结论。对TCGA队列的临床和病理因素进行多变量分析发现,IIRS评分与不良预后显著相关,阳性组没有特异性富集复发突变表明PIK3R5表达和IIRS评分预测PI3Kγ依赖性,并可能定义炎症相关的白血病亚群。
为了进一步确定先天炎症信号和PIK3R5表达之间的关系,研究人员用Resiquimod治疗白血病细胞系,结果显示治疗后显著提高基线PIK3R5低表达的白血病细胞,所有细胞系的PIK3CG mRNA水平没有变化,但PIK3CG蛋白水平与PIK3R5平行升高。Resiquimod治疗增加了PIK3R5的表达和对eganelisib的敏感性,表明先天炎症信号的激活有助于PIK3R5表达的升高。

图2 固有炎症信号激活的PIK3R5定义的白血病亚群共有对PI3Kγ亚基的选择性依赖
三、PU.1激活PIK3R5,促进PI3Kγ复合物自稳定
研究人员通过高通量测序(ATAC-seq)测定8个AML、ALL和BPDCN PDX的转座酶及染色质来寻找什么是促进PIK3R5表达升高和对PI3Kγ复合物依赖的上游转录激活因子。测量结果显示,无论白血病组织学如何,PIK3R5水平高的细胞比PIK3R5水平低的细胞更容易接近PIK3R5转录起始位点(TSS)周围的染色质区域。分析了来自ENCODE数据库的染色质免疫沉淀和测序(ChIP-seq)数据,确定了34个与PIK3R5启动子TSS附近相互作用的转录调控因子,在编码这34个转录调控因子的基因中,SPI1和ASH2L是全基因组CRISPRi筛选的核心依赖基因,因此研究人员假设其中一种转录调节因子可能控制PIK3R5的激活。
研究人员分别敲除SPI1和ASH2基因,测量PIK3R5的表达是否受影响。结果显示,敲除SPI1基因显著降低PIK3R5 mRNA和蛋白的水平,而SPI1编码转录因子PU.1,该因子在髓细胞和淋巴细胞分化和造血干细胞维持中发挥重要作用。ChIP分析观察到Resiquimod处理后PU.1与PIK3R5启动子之间的关联增加,表明PU.1是PI3Kγ依赖性白血病亚群中介导PIK3R5激活的关键转录因子。而敲除ASH2基因PIK3R5使PIK3CG的蛋白水平降低,但PIK3R5或PIK3CG的缺失并不影响对方的mRNA表达。研究人员认为PIK3R5和PIK3CG蛋白可能会相互保护,从而增加它们在细胞中的半衰期,为了验证这种可能性,研究人员用蛋白质合成抑制剂艾美汀处理CAL-1细胞,并监测PIK3R5和PIK3CG蛋白的稳定性。结果显示,PIK3CG的缺失显著降低了PIK3R5蛋白的稳定性,反之亦然。通过泛素化实验发现PIK3R5或PIK3CG的缺失增强了对方的泛素化,进一步支持了研究人员对这种共享蛋白保护机制的假设
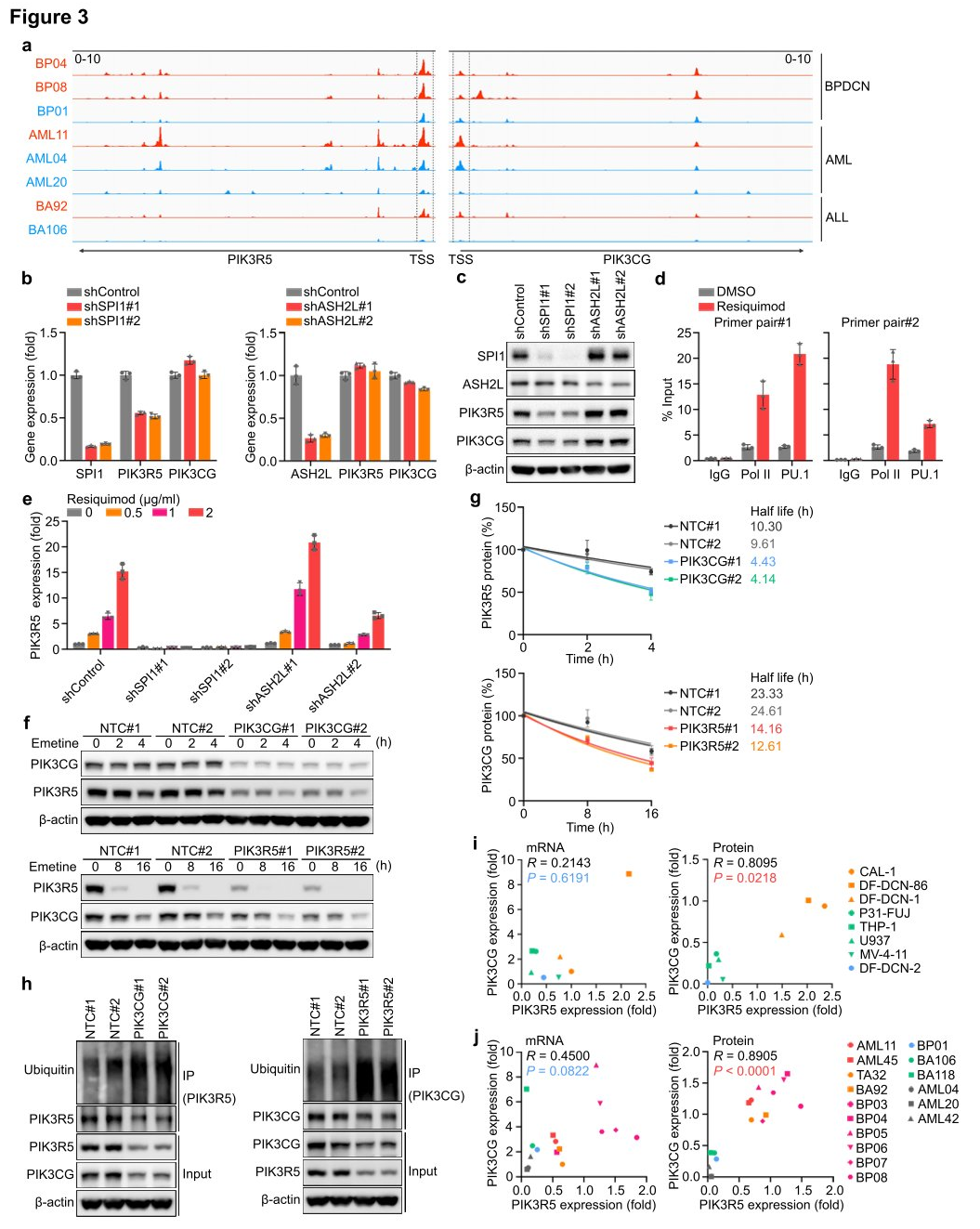
图3 PIK3R5被PU.1转录激活并保护PI3Kγ复合物免受UPS介导的降解。
四、PI3Kγ抑制OXPHOS并激活NFkB相关的转录网络
为了研究白血病细胞内在PI3Kγ依赖性的下游事件,研究人员使用eganelisib处理的CAL-1细胞或使用CRISPRi (PIK3R5i)去除PIK3R5的CAL-1细胞进行整合的RNA序列、蛋白质组学和磷酸化蛋白质组学分析。在抑制或耗尽的情况下,来自细胞转录组的GSEA表明,靶向PI3Kγ后最显著下调的分子事件与OXPHOS有关,这为通过抑制PI3Kγ选择性靶向白血病细胞中的线粒体提供了额外的理论依据。在eganelisib治疗后,11个持续升高的基因(RHOB、EGR1、CD69、SGK1和EGR3)和PIK3R5i中有5个位于该基因集的核心富集组内,其中几个在各种癌症中具有肿瘤抑制作用。为了验证这些核心富集基因中的一个或多个是否会导致PIK3R5相关白血病亚群对PI3Kγ抑制,研究人员在CAL-1和DF-DCN-1细胞中进行验证,结果敲除5个基因中4个降低了对PI3Kγ抑制的敏感性。用选择性NFkB抑制剂IKK-16和SC-514处理CAL-1细胞,发现eganelisib不再增加这5个基因的表达。代谢分析显示,NFkB抑制阻断了PI3Kγ抑制剂对OXPHOS的抑制,且用NFkB抑制剂处理的CAL-1细胞对eganelisib产生了耐药性。研究数据表明,部分由NFkB相关转录网络介导了PI3Kγ依赖性。

图4 PI3Kγ抑制激活NFkB相关转录网络并抑制白血病细胞中的OXPHOS
五、I3Kγ抑制不依赖于Akt激酶(Akt)的非典型PI3K通路
研究人员通过磷酸化蛋白质组学测量,发现PI3Kγ抑制后,AKT磷酸化在CAL-1细胞中没有明显变化。GSEA还显示,经典的PI3K-AKT-mTOR信号靶基因在eganelisib处理或PIK3R5缺失后均未发生改变,表明非典型PI3K介质可能有助于PIK3R5相关白血病亚群对PI3Kγ的依赖。通过进一步分析蛋白质组学和磷酸化蛋白质组学数据,研究人员发现几种蛋白质的磷酸化受到PI3Kγ抑制和PIK3R5缺失的影响,Western blotting证实,在PIK3R5/PIK3CG缺失后,PAK1丝氨酸144位点的磷酸化(S144)显著降低,而典型PI3K信号中其他已知蛋白的磷酸化未发生。值得注意的是,PIK3R5或PIK3CG的缺失导致AKT磷酸化的互补增加,而eganelisib则诱导AKT磷酸化的抑制。
为了进一步验证PAK1S144磷酸化在PI3Kγ依赖性中的功能参与,研究人员用PAK1或AKT的选择性抑制剂处理CAL-1细胞。PAK1抑制剂处理模拟了PI3Kγ抑制所观察到的对CAL-1生长的强烈抑制,尽管AKT抑制剂MK-2206完全消除了AKT磷酸化,但仅轻微损害了细胞活力。将外源性组成活性(S144D)或非活性(S144A) PAK1磷酸化位点突变体引入CAL-1细胞,并用eganelisib处理,赋予了对PI3Kγ抑制的抗性。最后,研究人员测试了PAK1S144磷酸化对PI3Kγ下游事件的影响。海马实验表明,PAK1S144D的引入消除了PI3Kγ抑制对OXPHOS的抑制,eganelisib诱导的NFkB相关肿瘤抑制基因的升高在表达PAK1S144D的CAL-1细胞中也减少,表明PAK1在白血病-内在依赖通路中是PI3Kγ的关键底物,PAK1S144的磷酸化在该信号通路中起重要作用。

图5 白血病细胞依赖于PAK1对PI3Kγ复合物产生内在依赖性
六、抑制PI3Kγ与阿糖胞苷协同治疗白血病
为了探索靶向PI3Kγ在白血病中的翻译潜力,研究人员使用两种PIK3R5升高的BPDCN细胞系测试了eganelisib与阿糖胞苷的联合应用,并在两种细胞系中观察到eganelisib和阿糖胞苷之间存在显著的协同效应。接下来,研究人员利用DF-DCN-86皮内异种移植模型评估体内白血病细胞对eganelisib和阿糖胞苷单独或联合使用的动态反应。结果显示单药eganelisib比单药阿糖胞苷更有效,两药联合使用对肿瘤生长产生协同抑制作用,在接受eganelisib或eganelisib加阿糖胞苷治疗的动物中,对治疗后立即收获的肿瘤裂解物进行western blot检测显示,PAK1S144磷酸化减少,但T423磷酸化没有减少。最后,研究人员测量了PI3Kγ抑制对六种播散性PDX模型存活的影响。结果显示,单药eganelisib显著延长了PIK3R5高的AML、ALL和BPDCN患者的生存期,而对于PIK3R5低的患者则没有任何益处。
基于体内疗效,研究人员试图了解为什么eganelisib和阿糖胞苷联合使用即使在没有升高的PIK3R5的白血病中也具有协同作用。在阿糖胞苷浓度下对三种PIK3R5低表达的PDX进行体外治疗,导致约20%的持续性白血病细胞,以便于分析残留疾病。结果显示,阿糖胞苷持久性细胞显示PAK1S144的磷酸化显著升高,而AKT S473则没有,这可能解释了它们诱导的eganelisib敏感性。研究数据表明,激活的G蛋白偶联嘌呤能受体PI3Kγ- PAK1信号在阿糖胞苷持久性残留白血病中也可能被PI3Kγ抑制靶向,扩大了PI3Kγ抑制剂在没有基线PIK3R5激活的白血病中的潜在临床应用。
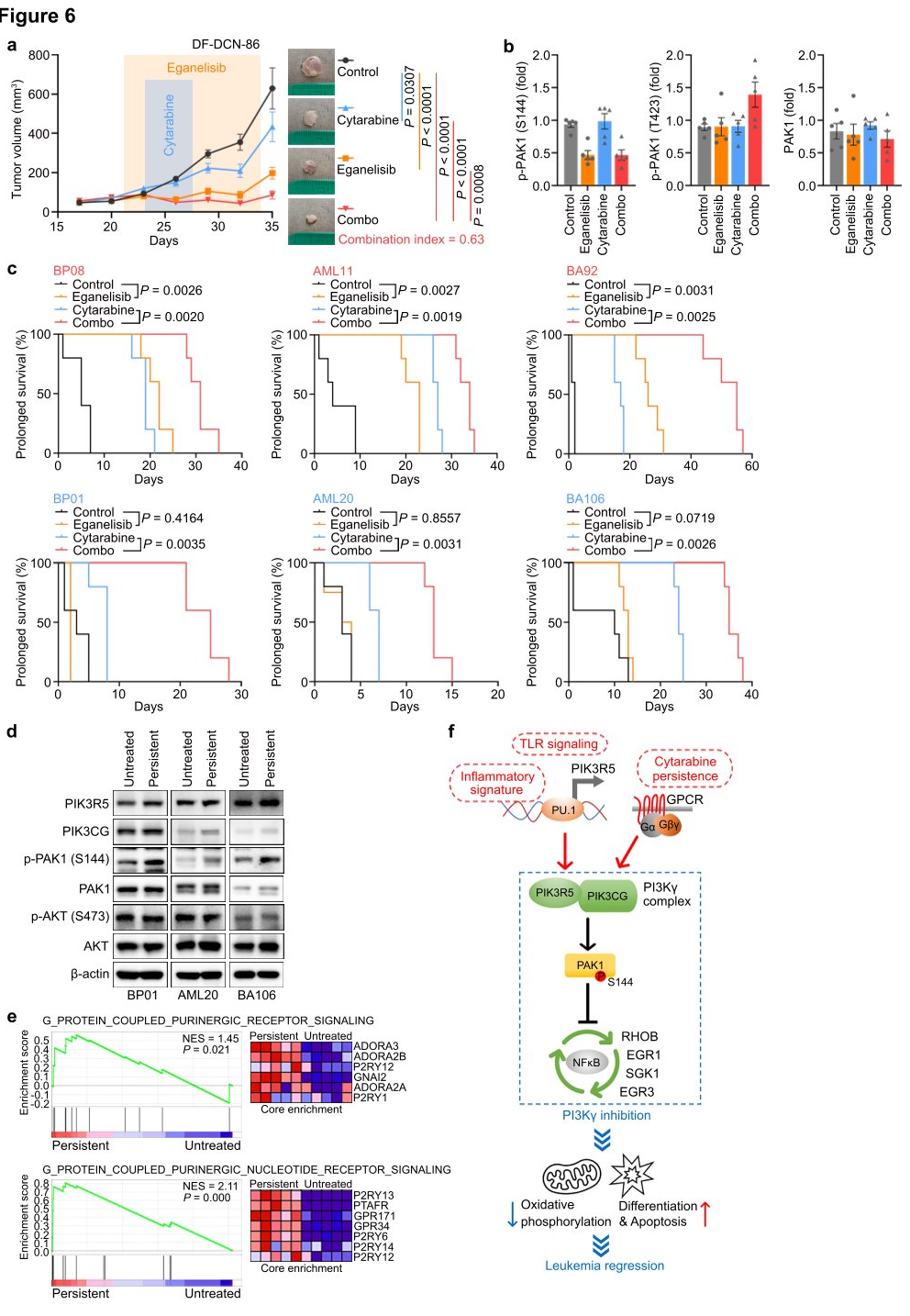
图6 Eganelisib与阿糖胞苷协同治疗白血病
综上所述,研究人员使用CRISPRi筛选技术结合了无偏的基因组范围筛选和功能性分析,在BPDCN(浆细胞样树突细胞肿瘤)和其他急性白血病(包括AML和ALL)的高风险亚群中,发现了对PI3Kγ复合体的选择依赖性,揭示p21 (RAC1) 激活激酶1 (PAK1) 作为PI3Kγ的一个非典型底物,为急性白血病提供了新的治疗靶点。
原文链接:https://doi.org/10.1038/s41586-024-07410-3
艾迪基因提供CRISPR文库筛选的一站式完整解决方案,CRISPR KO/CRISPRa/CRISPRi均可提供,还有国内最全文库质粒/ 病毒现货集合,现货一周达,下单即筛!
点击图片查看详情
近期资讯
1.【前沿资讯】基因编辑新动向——FGFR1、BRD4和BACE1基因敲除细胞
3.聊聊基因编辑技术的前世今生:ZFN、TALEN、CRISPR
联系我们
18102225074(微信同号)
market@edgene.cn




