【文献解读】CRISPR筛选助力发现多发性骨髓瘤治疗的关键靶点

多发性骨髓瘤(MM)是一种血液恶性肿瘤,其特点是骨髓中的浆细胞发生多步转化,导致多器官损伤。虽然硼替佐米(BZB)等蛋白酶体抑制剂在临床上取得了一定的疗效,但耐药性仍然是一个重要的障碍,使得多发性骨髓瘤成为一种无法治愈的疾病。以往的研究已经逐渐揭示了非编码基因在MM肿瘤发生和药物反应性中的作用,尤其是长非编码RNA(lncRNA),它们不仅调控基因表达,还具有作为治疗靶点的潜力。然而,目前大多数非编码RNA在MM中的功能尚未被充分了解。

意大利 Magna Graecia 大学和 Human Technopole 的研究小组最近在blood(IF: 21)杂志上发表了一项重要研究,题为“An unbiased lncRNAs dropout CRISPR-Cas9 screen reveals RP11-350G8.5 as a novel therapeutic target for Multiple Myeloma”。通过CRISPR-Cas9筛选,他们发现长非编码RNA(lncRNA)RP11-350G8.5对多发性骨髓瘤细胞的存活至关重要,并且与患者的不良预后密切相关。进一步研究显示,RP11-350G8.5的抑制在体内外均表现出显著的抗肿瘤效果,尤其是在对硼替佐米(BZB)耐药的患者中,展现了其作为新型治疗靶点的巨大潜力。这一发现为多发性骨髓瘤的治疗开辟了新的途径,特别是在克服药物耐药性方面提供了新的希望。
一、长非编码RNA的缺失CRISPR-Cas9筛选在多发性骨髓瘤细胞系中的应用
研究团队利用经过验证的第三代慢病毒CRISPR-Cas9文库,在多发性骨髓瘤(MM)细胞系AMO-1及其抗BZB亚克隆(ABZB)上对671个长非编码RNA(lncRNA)进行了隐性集合CRISPR-Cas9筛选。在文库转导30天后,团队通过NGS测序技术跟踪存活细胞中整合的pgRNA盒,根据过度/低度表达情况量化lncRNA对细胞生长的依赖性。AMO-1和ABZB的筛选质量在预期范围内,表明这种方法是可靠的。在筛选过程中,与非靶向引导基因和对照基本基因相比,靶向 lncRNA 的 pgRNA 表现出很大范围的损耗对折变化(logFC)。通过排除核糖体蛋白基因和其他对照基因,他们发现了42个显著减少细胞生长或诱导MM细胞死亡的非蛋白编码位点(AMO-1中14个,ABZB中37个),假发现率(FDR)≤20%。值得注意的是,有9个依赖性在两个细胞系中是共同的,且在统计分析中表现出显著性,证明了这些依赖性在MM特异性和基因组背景独立性方面的重要地位。
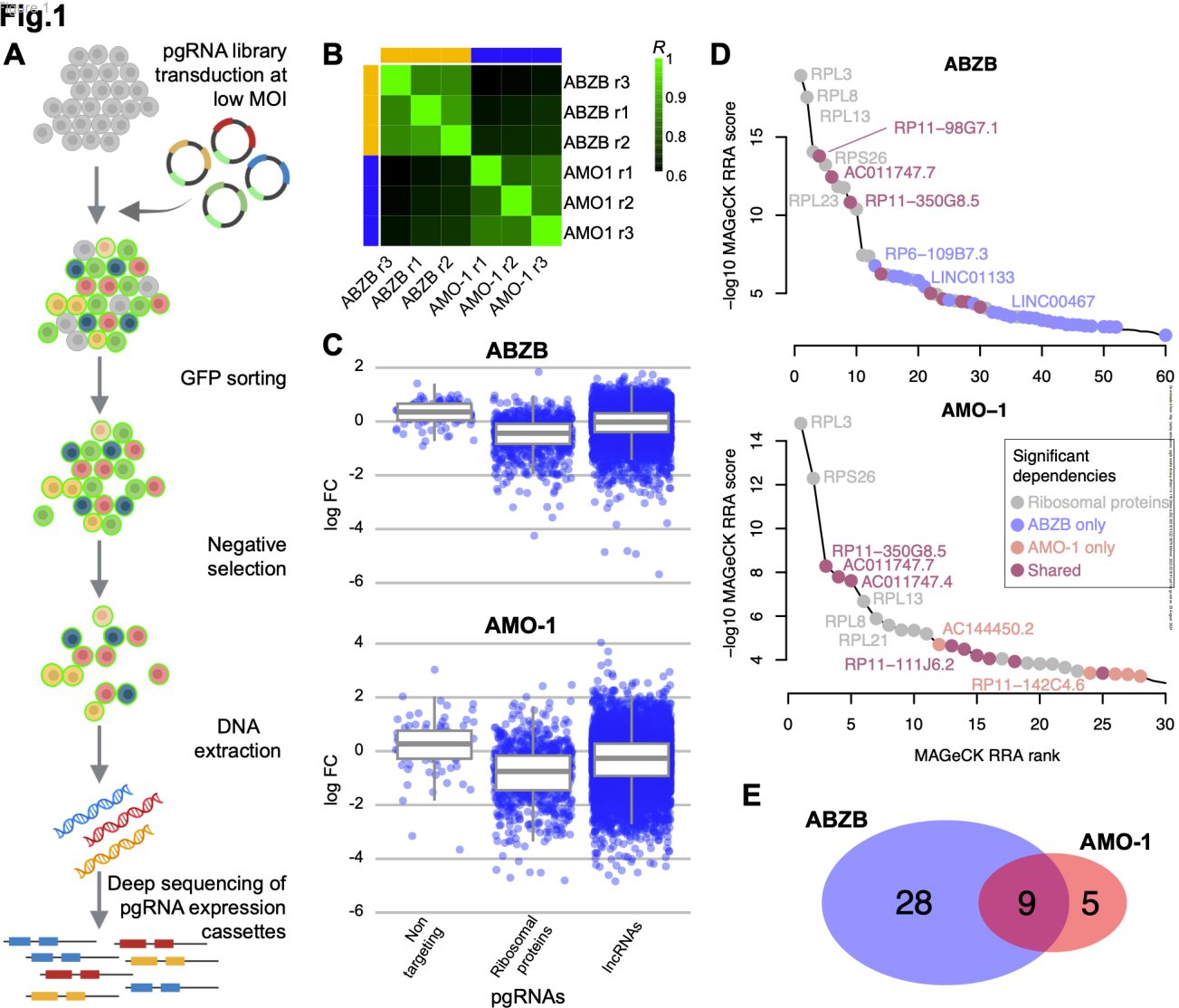
图1 LncRNA的缺失CRISPR-Cas9筛选在多发性骨髓瘤细胞系中的应用
二、筛选结果和依赖性分析
研究小组利用MAGeCK分析方法确定了对MM细胞健康有显著影响的lncRNA,过滤掉了控制必需基因和没有表现出显著影响的非靶向lncRNA,进一步缩小了候选基因的范围。随后,他们重点研究了在768名MM患者中基础表达水平显示出显著预后能力的lncRNA,最终确定了8个具有潜在致癌潜力的未表征lncRNA作为多发性骨髓瘤的候选基因。该过程不仅通过基因表达分析确定了lncRNA的致癌潜力,还为后续的功能研究和临床验证提供了基础。对每个候选基因的表达进行深入分析,发现一些lncRNAs在MM患者中明显上调,与疾病的严重程度和预后相关。通过对这些lncRNA的研究,研究人员希望能够揭示其在MM病理过程中的具体功能。
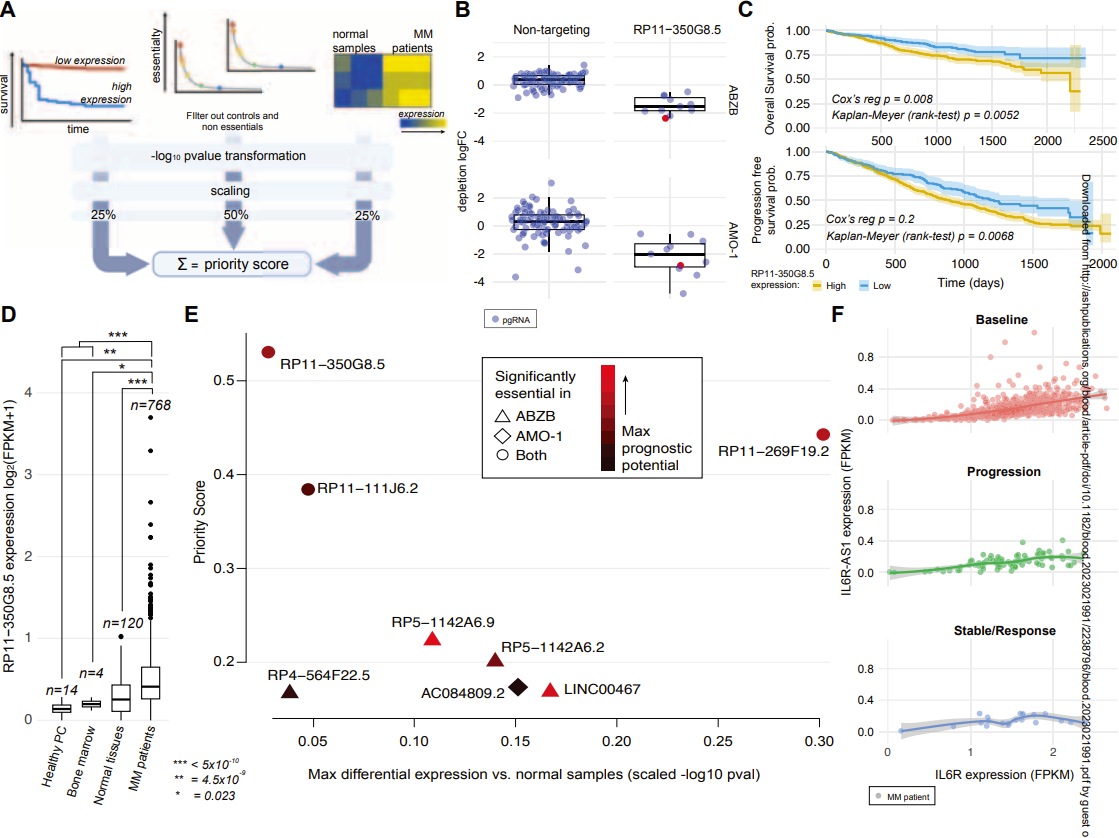
图2 LncRNA优先选择方案及结果
三、筛选高优先级的致癌 lncRNA 候选者
在对AMO-1和/或ABZB细胞健康至关重要的8个优先lncRNA中,之前无特征的RP11-350G8.5(别名IL6R-AS1)作为顶级候选者脱颖而出。其高优先级得分源于在AMO-1和ABZB中的显著必要性,与MM患者的预后差异显著相关,且在MM患者中的上调。RP11-350G8.5在AMO-1和ABZB细胞系中表现出的损耗对折变化(logFC)分别为-1.53和-2.02,MAGeCK假发现率(FDR)为6.5 × 10-4和2.6 × 10-4。此外,该lncRNA的上调与MM患者的预后不良密切相关,表明其在肿瘤发展中的关键作用。为了验证RP11-350G8.5的功能,研究团队将其表达与其反义基因(IL-6R)的表达进行了比较,结果发现并没有明显证据表明RP11-350G8.5对IL-6R有负向调节作用。值得注意的是,IL-6R在AMO-1中并非必需基因,进一步表明RP11-350G8.5的致癌作用与其抗义基因的调控无关。
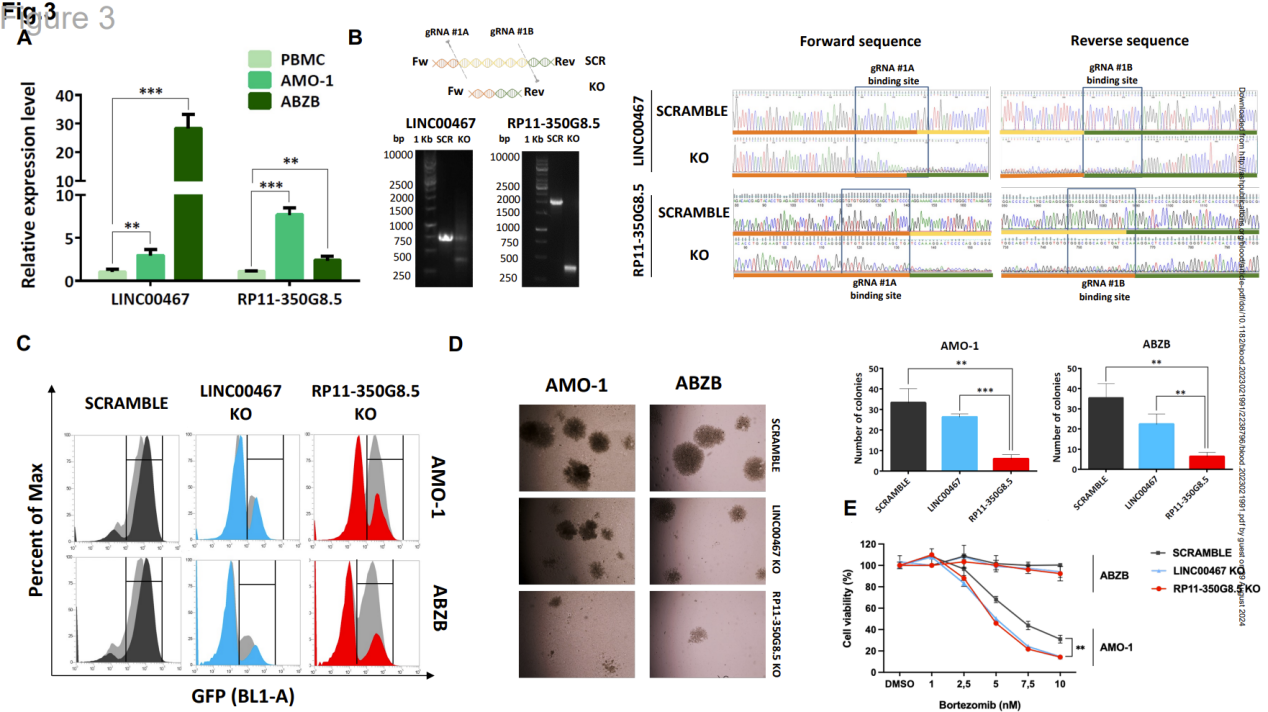
图 3 对优先考虑的致癌 lncRNA 候选者进行功能验证
四、RP11-350G8.5与LINC00467的表达评估
研究人员通过qRT-PCR验证了RP11-350G8.5和LINC00467在ABZB和AMO-1细胞系中的过表达,并与来自健康供体的外周血单核细胞(PBMC)进行了比较。这些lncRNA的表达水平明显高于正常细胞,表明它们可能在多发性骨髓瘤(MM)的发生和发展中发挥着重要作用。值得注意的是,RP11-350G8.5在MM细胞中的表达水平一直较高,这表明它在肿瘤微环境中具有潜在的致癌特性。进一步的分析表明,与 LINC00467 相比,RP11-350G8.5 的基础表达较低,这可能表明它在细胞过程中发挥着不同的功能作用。尽管目前的研究结果令人鼓舞,但对这两个lncRNA的具体机制和相互作用仍需深入探讨。这一发现为了解MM中lncRNA的功能提供了基础,尤其是在耐药性和细胞增殖方面。
在比较硼替佐米(BZB)治疗患者的表达水平的研究中,研究人员发现,与正常组织相比,RP11-350G8.5在MM患者中明显升高。这一结果表明,RP11-350G8.5在肿瘤细胞存活过程中起着关键作用,可能与耐药性的产生密切相关。此外,LINC00467的高表达与RP11-350G8.5之间存在正相关关系,表明这两个lncRNA可能共同影响MM的进展。因此,针对RP11-350G8.5的靶向疗法可为克服BZB耐药性提供新策略,并为临床治疗方法提供新见解。
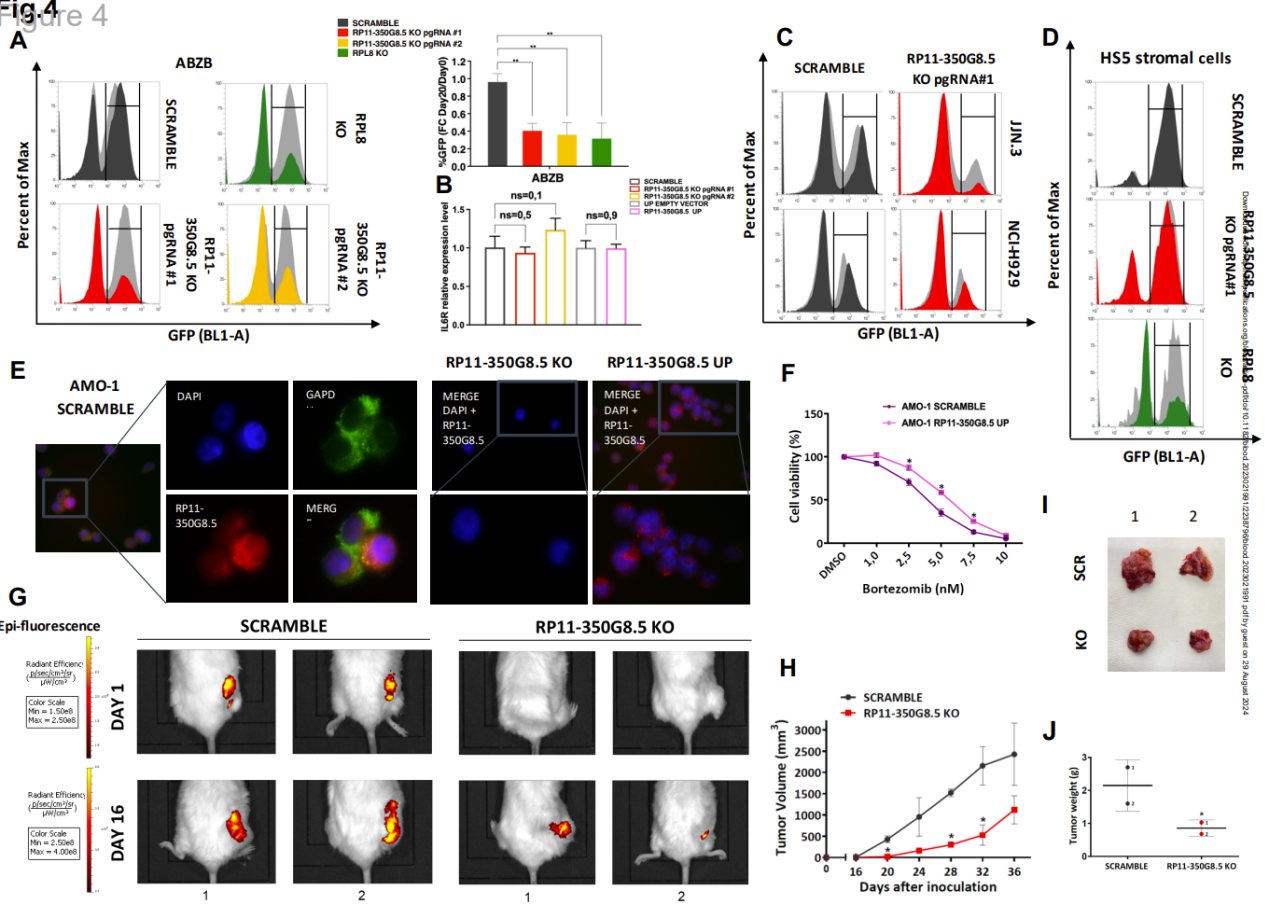
图4 RP11-350G8.5的潜在致癌作用:体外验证及来自体内模型的初步数据
五、RP11-350G8.5和LINC00467在多发性骨髓瘤中的作用
研究人员进一步探讨了RP11-350G8.5和LINC00467在多发性骨髓瘤(MM)中的功能及其相互作用。这两个lncRNA的表达水平与肿瘤细胞的生存能力、增殖能力及对化疗药物的耐药性密切相关。特别是RP11-350G8.5的高表达与MM患者的不良预后相关,提示其在肿瘤发生和进展中的潜在致癌作用。通过基因敲除实验,他们发现抑制RP11-350G8.5的表达可以显著降低MM细胞的增殖能力,增加细胞凋亡率。这一发现表明,RP11-350G8.5不仅对MM细胞的生存至关重要,而且可能通过调控关键生存信号通路影响肿瘤的耐药性。同样,LINC00467的过表达也与细胞存活相关,且其在MM细胞中的功能亟待进一步研究。
此外,他们还考虑了这两个lncRNA在不同肿瘤微环境中的作用,尤其是在与骨髓基质细胞(BMSCs)相互作用时的影响。BMSCs能够为肿瘤细胞提供保护性信号,而RP11-350G8.5和LINC00467的表达水平可能影响这一相互作用,进一步影响MM的耐药性和细胞存活。这两种lncRNA的相互作用和功能特点为治疗MM提供了新的视角,特别是针对这些lncRNA开发靶向疗法,可能会产生显著的临床疗效。研究团队还在考虑利用基因编辑技术验证这些lncRNA在不同MM细胞系中的特异功能,从而为后续的临床应用提供理论支持。
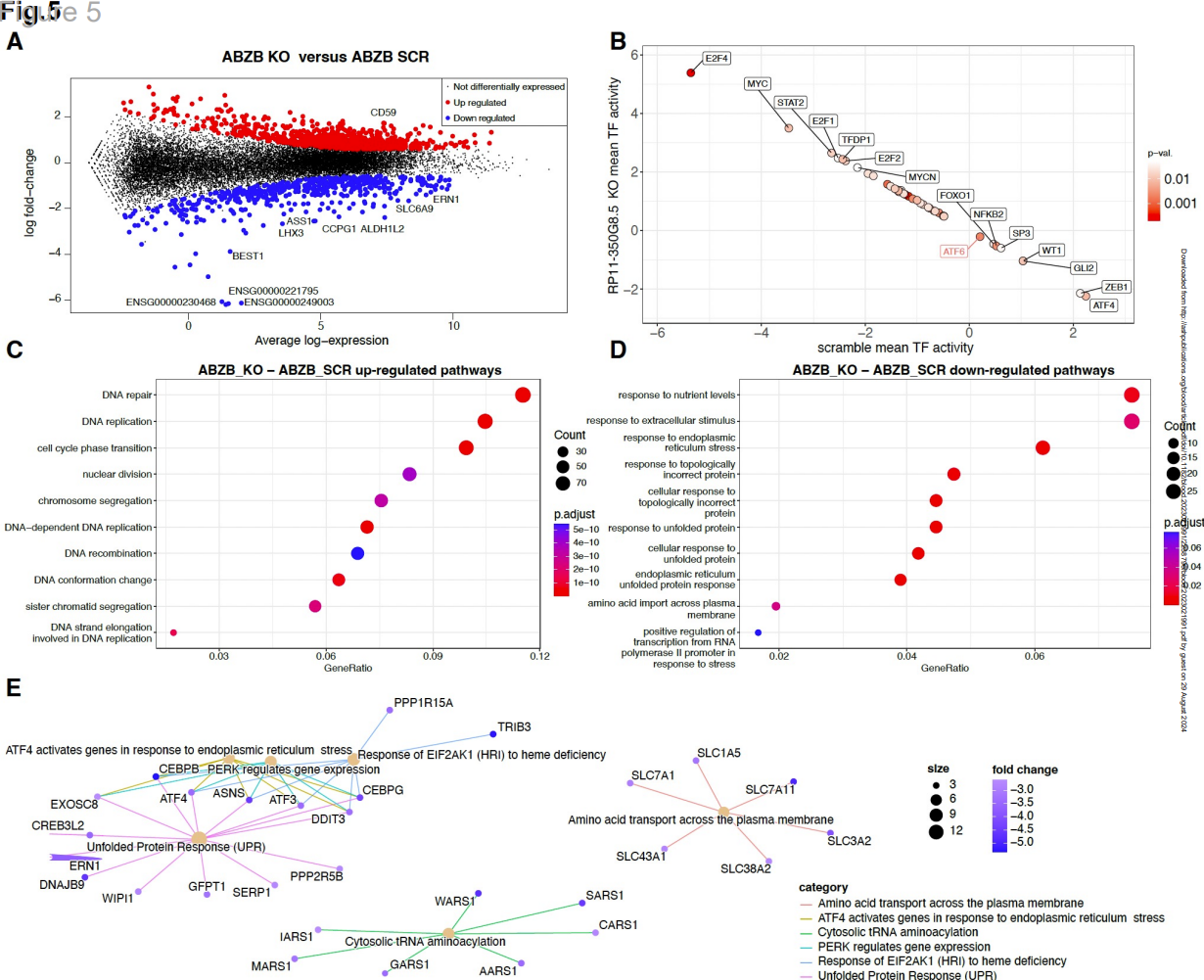
图5 RP11-350G8.5敲除(KO)后ABZB细胞系的差异表达和通路富集分析
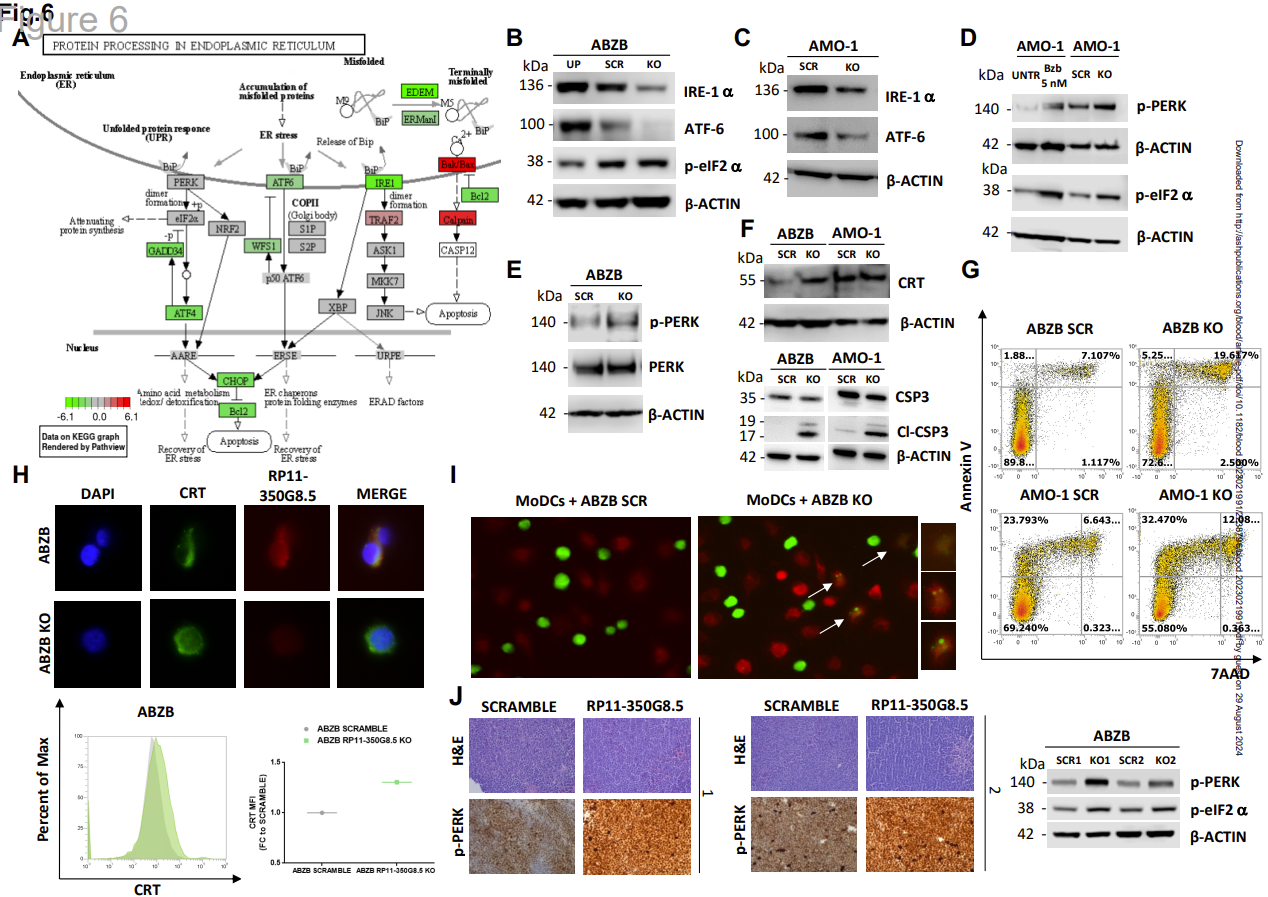
图6 RP11-350G8.5结构特征的表征
总体来说,本研究通过对长非编码RNA(lncRNA)进行CRISPR-Cas9筛选,揭示了RP11-350G8.5和LINC00467在多发性骨髓瘤(MM)细胞中的重要作用。这两个lncRNA的表达与肿瘤细胞的生存、增殖及对Bortezomib(BZB)耐药性密切相关。研究表明,RP11-350G8.5的高表达与MM患者的不良预后显著相关,且抑制其表达可显著降低细胞增殖能力,增加细胞凋亡。此外,LINC00467的高表达也与细胞存活密切相关,说明其在肿瘤进展中可能发挥重要作用。
研究还发现,这两个lncRNA之间可能存在协同作用,对MM的发生和发展有着潜在的影响。因此,未来的研究应集中于深入探讨这两个lncRNA的具体功能机制及其在MM治疗中的潜力,特别是如何通过靶向这些lncRNA来克服耐药性。此外,通过结合临床数据,研究团队可以为个体化治疗提供新的策略,进一步改善MM患者的治疗效果和生活质量。
原文链接:https://doi.org/10.1182/blood.2023021991
艾迪基因提供CRISPR文库筛选的一站式完整解决方案,CRISPR KO/CRISPRa/CRISPRi均可提供,还有国内最全文库质粒/ 病毒现货集合,现货一周达,下单即筛!
近期资讯
1.【一周时讯】工业污染物与脂肪肝存在致命联系?CRISPR筛选揭示相关答案
2.【文献解读】CRISPR筛选揭示去除TREX1可增强CRISPR-Cas9介导的同源定向修复效率
3.【一周时讯】CRISPR家族新成员:VII型CRISPR-Cas系统为基因编辑带来新突破!
联系我们
18102225074(微信同号)
market@edgene.cn



