【文献解读】CRISPR筛选揭示神经干细胞的衰老关键调控因子

成年哺乳动物的大脑包含多个具有神经干细胞(NSCs)的区域,这些细胞能够生成新的神经元并修复中风或损伤造成的损害。其中,脑室下区(SVZ)是最活跃的NSCs微环境,该区域储存着休眠的NSCs,这些细胞可以被激活,分裂产生祖细胞,迁移至嗅球并分化成为神经元。然而,随着年龄增长,NSCs的活性显著下降,导致感官和认知功能的退化。鉴定出影响神经干细胞(NSCs)激活的基因,将有助于开发干预措施,以缓解与年龄相关的脑功能退化。然而,目前的基因干预都集中在少数几个基因上,现有的CRISPR-Cas9技术也还未应用于正常的老化细胞。如果能够开发出这样的筛选平台,很可能会揭示增强组织功能的基因调控方法,为我们应对衰老大脑中的再生能力和认知功能下降问题提供新的思路。

为了系统性地鉴定随着年龄增长能够增强NSCs活性的基因,来自美国的研究人员开发了一种基于CRISPR-Cas9全基因组敲除筛选的平台,应用于来自年轻和老年小鼠的原代NSCs培养物中。相关研究成果发表在《Nature》期刊,题为《CRISPR-Cas9 Screens Reveal Regulators of Ageing in Neural Stem Cells》。该平台高效且具备可扩展性,使研究人员能够在体内直接研究细胞衰老的关键调控因子,适用于老年小鼠的不同细胞类型,并与其他CRISPR-Cas9技术兼容。通过靶向老化组织,这些基因干预可能揭示出延缓或逆转衰老的新策略,为解决与衰老和神经退行性疾病相关的认知和再生能力下降问题提供新的思路。
一、通过CRISPR-Cas9筛选提升衰老NSCs的活性
原代NSCs在不同生长因子的刺激下,可以在静止(qNSC)和活化(aNSC)状态之间转换。然而,老年小鼠的NSCs活化能力较差,这也反映了体内的衰老现象。为了建立筛选平台,研究人员使用表达Cas9的小鼠,从其脑室下区分离出NSCs,进行全基因组CRISPR-Cas9敲除筛选。超过4亿个静止状态的NSCs被转导了靶向约23,000个编码蛋白的基因文库。激活这些细胞后,进行高通量测序,识别出促进或抑制活化的基因。结果显示,共识别出654个与活化增强相关的基因,以及1,386个与抑制活化相关的基因。研究还发现,年轻和老年NSCs的活化反应存在显著差异。
基因本体分析表明,促进老年NSCs活化的基因敲除与纤毛组织和葡萄糖转运等功能相关,突显了葡萄糖代谢在衰老NSCs中的新作用。这项研究提供了一个全面的数据集,揭示了能够促进静止状态向活化状态转变的关键基因,为深入理解神经干细胞衰老机制提供了新的见解。
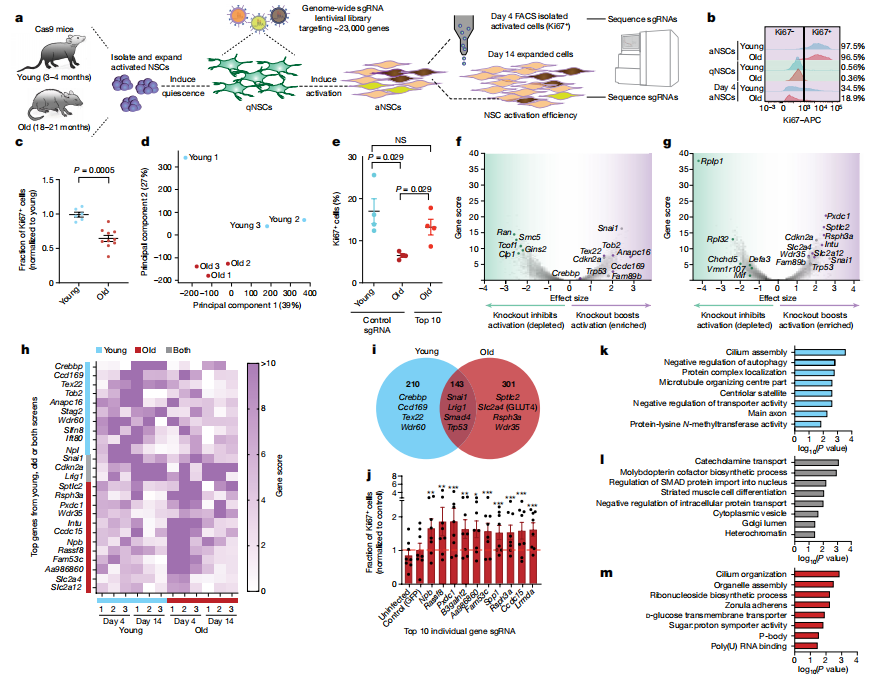
图1 全基因组筛选发现300个基因敲除可增强衰老NSCs的活化
二、对老年小鼠大脑进行CRISPR-Cas9筛选
研究人员利用基因敲除筛选平台,靶向老年Cas9小鼠的脑室下区(SVZ)。通过立体定位手术,将表达sgRNA和mCherry的慢病毒注射到侧脑室,靶向NSCs。五周后,基因敲除得以确认,NSCs后代迁移至嗅球。该方法利用SVZ的再生能力评估基因敲除对NSCs活化和神经发生的影响。使用不同的sgRNA文库,测试的50个基因敲除中有24个在嗅球中显著富集,增强了老年NSCs功能。部分抑制活化的基因敲除表现出轻微减少,反映了老年小鼠中神经发生的下降。这一体内筛选平台识别了与NSCs衰老相关的关键基因,包括纤毛、葡萄糖代谢和核糖核蛋白。该方法为理解影响NSCs功能的遗传因素提供了见解,并为潜在的治疗干预提供了新方向。
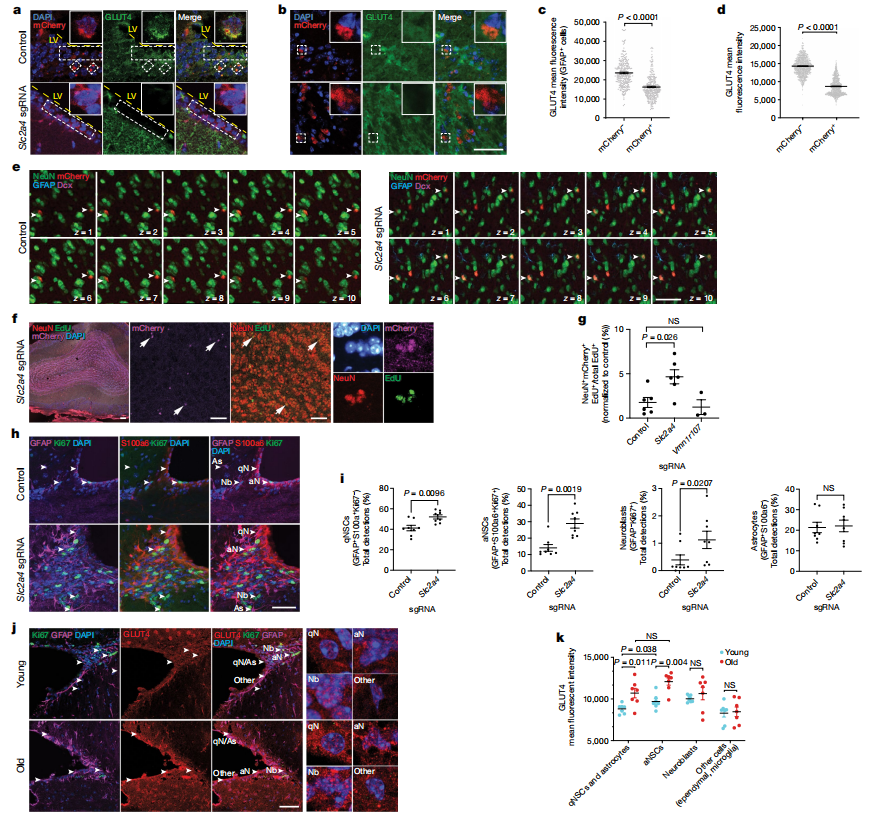
图2 用于快速测试基因敲除对NSCs活化影响的体内筛选平台
三、敲除GLUT4促进神经发生
敲除葡萄糖转运蛋白GLUT4(Slc2a4)已成为增强老年NSCs功能的有效策略,适用于体内外实验。本研究旨在确定减少脑室下区(SVZ)中GLUT4的表达是否能促进老年个体的神经发生。研究人员通过立体定向注射靶向Slc2a4的sgRNA到老年Cas9小鼠的脑室,成功降低了注射五周后SVZ和嗅球中的GLUT4水平。每周注射EdU以追踪新生成的细胞。结果显示,嗅球中的mCherry+新生细胞显著增加,且其中许多细胞表达神经元标志物NeuN和TUJ1,证实了Slc2a4敲除显著促进神经发生。免疫荧光分析显示,SVZ微环境中的静止NSCs(qNSCs)和活化NSCs(aNSCs)数量增加,表明GLUT4的耗减促进了对称分裂,而不会耗尽NSCs群体。此外,研究还发现GLUT4在老年个体的NSCs和星形胶质细胞中表达增加,表明GLUT4可能随着年龄增长对NSCs功能产生不利影响。这些发现表明,GLUT4水平的年龄相关增加可能会抑制老年大脑中的神经发生,因此敲除GLUT4是增强老年人NSCs活性和神经发生的有效策略。
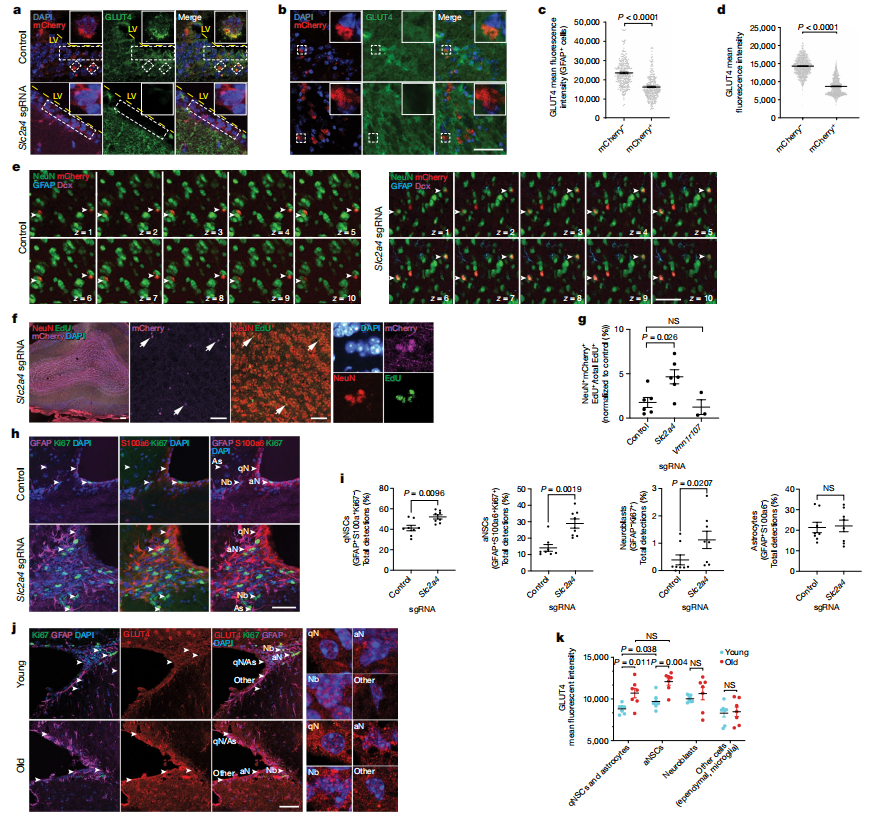
图3 Slc2a4在SVZ NSC微环境中的敲除促进了老年小鼠的神经发育
四、衰老NSCs会摄取更多的葡萄糖
老年神经干细胞(NSCs)通过葡萄糖转运蛋白GLUT4表现出增加的葡萄糖摄取能力,GLUT4随着年龄的增长而上调。研究人员分析了体外全基因组筛选结果,评估了葡萄糖摄取途径在NSCs衰老过程中的作用。结果表明,Slc2a4基因的敲除显著增强了老年NSCs的体外活化,并在体内促进了神经发生。相比之下,Slc2a12的敲除未显示出类似效果。单细胞RNA测序显示,只有Slc2a4在衰老的静止NSCs(qNSCs)中显著上调。免疫荧光染色进一步证实了老年qNSCs中GLUT4水平的适度增加。此外,敲除参与GLUT4转运的蛋白Stx4a也增强了老年NSCs的活化。尽管葡萄糖摄取增加,老年qNSCs表现出更高的糖酵解活性和较低的线粒体呼吸,这表明它们的代谢偏向以葡萄糖为主要能源。限制葡萄糖供应表明,Slc2a4敲除和短期葡萄糖饥饿显著促进了老年qNSCs的活化。使用糖酵解抑制剂2-脱氧-D-葡萄糖的处理进一步刺激了老年qNSCs的活化。
这些结果表明,GLUT4的高水平和葡萄糖摄取可能导致了老年NSCs的静止状态。总体而言,该研究强调了通过遗传或饮食干预靶向葡萄糖代谢以改善老年群体中NSCs功能的潜力,突出了代谢途径在调节衰老过程中干细胞活性中的重要作用。
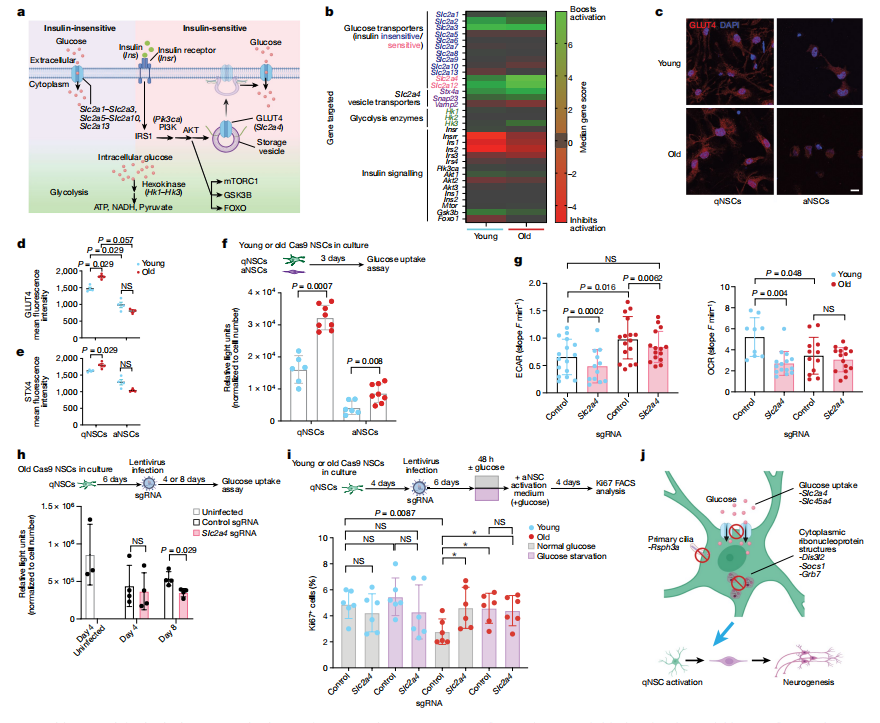
图4 老年NSCs摄取更多的葡萄糖,可通过靶向其代谢途径改善活化
总的来说,研究人员通过全基因组CRISPR-Cas9敲除筛选鉴定出300多个基因在被破坏后能增强衰老NSCs的体外活化。研究结果表明,葡萄糖摄取增加可能是细胞衰老的共同特征,与失调的胰岛素-葡萄糖信号有关,并与神经功能障碍和阿尔茨海默病相关。通过GLUT4敲除或葡萄糖限制来靶向这种增加的葡萄糖摄取,提供了应对衰老的有前景的策略。体内筛选平台的建立提供了一种可扩展的方法,用于发现新型基因干预措施,以恢复衰老组织的活力,特别是在大脑中,帮助应对认知能力下降和神经退行性疾病。这种方法强调了通过遗传或环境干预来延缓或逆转衰老过程的潜力。
原文链接:https://doi.org/10.1038/s41586-024-07972-2
艾迪基因提供CRISPR文库筛选的一站式完整解决方案,CRISPR KO/CRISPRa/CRISPRi均可提供,还有国内最全文库质粒/ 病毒现货集合,现货一周达,下单即筛!
近期资讯
1.【一周时讯】抵抗衰老!CRISPR/Cas9筛选揭示葡萄糖代谢基因对抗细胞衰老新方式
2.【文献解读】CRISPR筛选助力高阶遗传干扰研究的新突破
3.【一周时讯】揭秘时刻:CRISPRa和单细胞 RNA 测序揭示细胞类型之间的不同调节模式
联系我们
18102225074(微信同号)
market@edgene.cn



