 iPSC基因编辑
iPSC基因编辑
诱导多能干细胞(iPSCs)因其可无限增殖并分化为多种细胞类型的特性,已成为研究人类发育、疾病模型和药物筛选的重要工具。通过在 iPSC 中引入精确的基因编辑(如敲除、敲入、点突变或基因修复),研究人员能够在遗传层面模拟疾病状态,探索致病机制,并为个性化治疗和再生医学提供坚实基础。
艾迪基因依托自主优化的 CRISPR/Cas9、TALEN 与 Prime Editing 技术平台,我们提供高效率、低脱靶率的 iPSC 基因编辑服务。结合严格的单克隆筛选与多层次鉴定(测序、分化潜能检测等),确保 iPSC 编辑的准确性和稳定性。服务详情
| 服务类型 | 基因编辑的 iPS 细胞:敲除、敲入、点突变、过表达、干扰 |
|---|---|
| 交付成果 | 单克隆细胞≥1株(2管细胞/株,1x106/管) |
| 周期/价格 |
快至12周,28800元起 |
服务类型
服务优势
成熟的干细胞培养体系
成熟的基因编辑平台
科学的方案设计和实验体系,可高效获得符合需求的基因编辑iPS细胞模型
成功案例
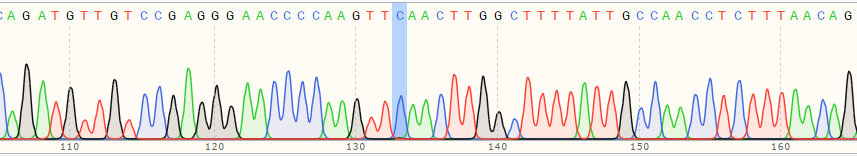
基于先导编辑平台构建在IPSC细胞中构建点突变细胞模型
| 细胞名称 | 编辑效率 | 测序峰图 |
|---|---|---|
| WT cell | / |
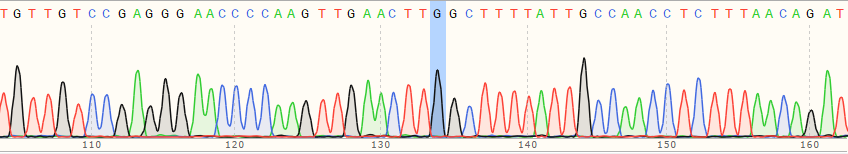 |
| A Polyclonal Cells | 10% |
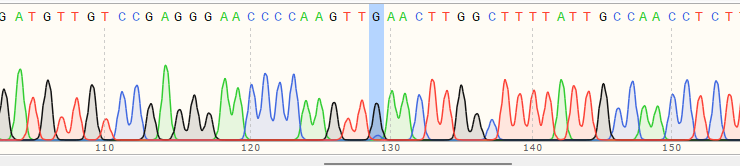 |
| B Polyclonal Cells | 55% |
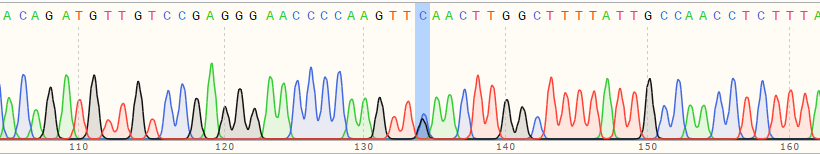 |
| C Polyclonal Cells | 17% |
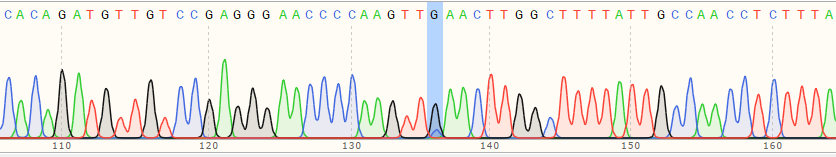 |
| Monoclonal Cell | 100% |
 |
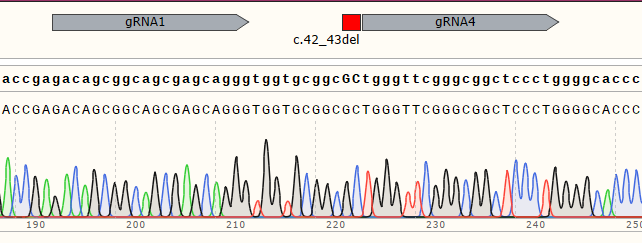
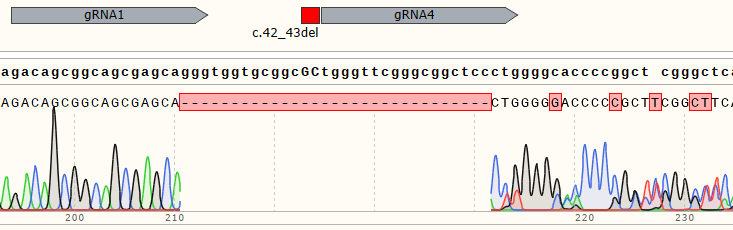
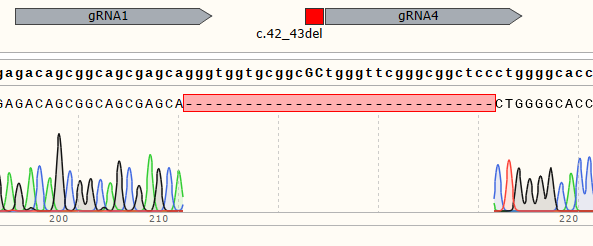
基于CRISPR/CAS9平台构建在IPSC细胞中敲除细胞模型
| 细胞名称 | 编辑效率 | 测序峰图 |
|---|---|---|
| WT cell | / |
 |
| Polyclonal Cells | 98% |
 |
| Monoclonal Cell | 100% |
 |
Advantage and Characteristic

Optimazied Strategy

Optimazied Strategy

Optimazied Strategy

Optimazied Strategy
参考文献
多能干细胞(iPSCs)衍生的巨噬细胞可作为研究病毒生物学的有效模型
这项研究评估了人源诱导多能干细胞(iPSCs)衍生的巨噬细胞是否可以作为研究病毒生物学的有效模型。研究发现,这些iPSC衍生的巨噬细胞能够支持HIV-1、登革病毒和流感病毒的复制,且其复制动力学和表型与传统的血液单核细胞衍生的巨噬细胞相似。通过流式细胞术、RNA测序和染色质可及性分析,iPSC衍生的巨噬细胞在表面标志物和基因表达特征上与人血液单核细胞衍生的巨噬细胞几乎没有区别。此外,从黑猩猩成纤维细胞中生成的iPSC系显示出对登革病毒的不同易感性,为研究病毒的种属嗜性提供了有价值的资源。研究还发现,无论是血液衍生还是iPSC衍生的巨噬细胞,都能在流感病毒生命周期的晚期限制病毒的复制。整体而言,iPSC衍生的巨噬细胞被证明是血液单核细胞衍生巨噬细胞的一个有效替代方案,用于病毒生物学的研究。
iPSC衍生的肺和肺癌类器官模型用于测试药物递送的效果
肺癌仍是全球癌症相关死亡的主要原因,尽管靶向治疗取得了进展,但耐药性和系统毒性依然是主要问题。研究人员探讨了使用患者特异性肺癌和正常肺组织类器官模型,以及自体诱导多能干细胞(iPSC)-MSC衍生的细胞外囊泡(EVs)在个性化医疗中的可行性。他们将健康成纤维细胞重编程为iPSC,分化为分支肺类器官(BLO)和患者匹配的肺癌类器官(LCO),并通过简化过程从iPSC-MSC中分离EVs,使用0.07 µg/mL cisplatin,应用于这两种类器官模型,并通过LDH和CCK8测试记录细胞毒性。结果显示,成纤维细胞来源的iPSC表现出正常核型和多能性,iPSC衍生的BLO和LCO显示肺标志物的表达。iPSC-MSC来源的负载cisplatin的EVs未在两种类器官模型中引起细胞毒性,而20 µg/mL的cisplatin则对LCO表现出细胞毒性。本研究展示了使用自体或同种异体iPSC-MSC EVs作为肺癌药物递送测试的初步验证方法。
Oct4、Sox2、Klf4和c-Myc四种关键因子可促进细胞重编程为iPSC
这篇文章探讨了通过特定转录因子将成熟的成纤维细胞转化为多能干细胞的技术。研究中使用了四种关键转录因子:Oct4、Sox2、Klf4和c-Myc。这些因子被导入小鼠胚胎成纤维细胞和成人成纤维细胞中,通过这些因子的作用,细胞逐渐获得了多能性特征,表现出与胚胎干细胞相似的形态和基因表达模式。研究发现,重编程后的iPSCs不仅在体外能够长期培养,还具有向各种细胞类型分化的能力,包括神经细胞、心肌细胞等,这表明这些iPSCs具有良好的生物学特性和潜在的应用价值。这项研究不仅验证了四种转录因子的有效性,还为未来干细胞研究提供了新的工具,尤其在再生医学和疾病治疗领域中具有重要的应用前景。
精选客户文章
Deep whole-genome analysis of 494 hepatocellular carcinomas
全球超过一半的肝细胞癌(HCC)病例发生在中国,但目前针对中国人群中乙型肝炎病毒(HBV)相关HCC的全基因组分析研究非常有限。为了突破这种限制,研究人员启动了“中国肝癌图谱项目”(CLCA),旨在对中国人群中的HCC进行大规模的全基因组分析以理解其独特的发病机制和进化过程。该项目对494例HCC肿瘤样本进行了深度全基因组测序(平均测序深度为120×),并分析了匹配的对照血液样本,揭示了HBV相关HCC的详细基因组特征。研究发现,除了已知的编码区驱动基因(如TP53和CTNNB1)外,还存在6个新的编码区驱动基因(包括FGA)和31个非编码区驱动基因。此外,研究还揭示5种新的突变特征(包括SBS_H8),以及HBV整合形成细胞外环状DNA(ecDNA)的现象,这些ecDNA可导致癌基因扩增和表达增加。通过功能验证实验,研究人员证实了FGA、PPP1R12B和KCNJ12等基因的突变能够显著影响HCC细胞的增殖、迁移和侵袭能力。这项研究结果不仅丰富了人们对HCC基因组学的理解,也为HCC的诊断和治疗提供了新的潜在靶点。
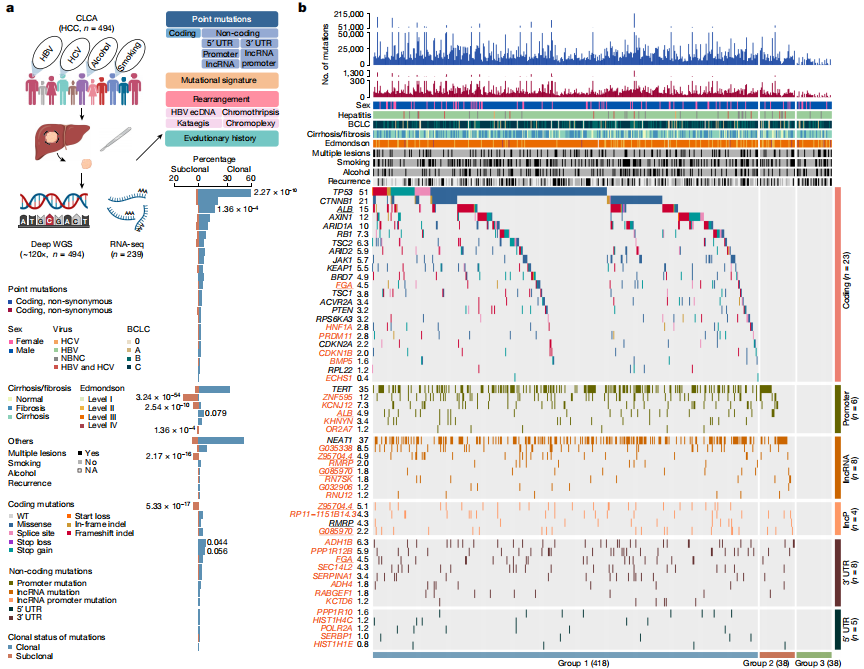
候选驱动因子概况
Targeted Macrophage CRISPR-Cas13 mRNA Editing in Immunotherapy for Tendon Injury
肌腱损伤急性炎症期中,巨噬细胞过度激活会导致编码骨桥蛋白OPN的SPP1过表达,影响组织再生。CRISPR-Cas13由于具有RNA编辑和快速降解的能力,在组织修复方面具有巨大潜力,但缺乏合适有效的递送方法。对此,研究人员系统筛选了针对巨噬细胞的阳离子聚合物,开发了一种能够高效递送Cas13核糖核蛋白复合物(Cas13 RNP)进入巨噬细胞的纳米簇载体。通过反应性氧种(ROS)响应性释放机制,该系统能够在肌腱损伤的急性炎症微环境中特异性抑制巨噬细胞中SPP1的过表达。实验结果表明,这种靶向策略显著减少了损伤诱导的SPP1产生巨噬细胞的出现,降低了成纤维细胞的激活,并减轻了肌腱周围的粘连形成。此外,该研究还揭示了SPP1通过CD44/AKT信号通路促进成纤维细胞活化和迁移的机制,并通过抑制这一通路有效缓解了肌腱损伤后的粘连问题。
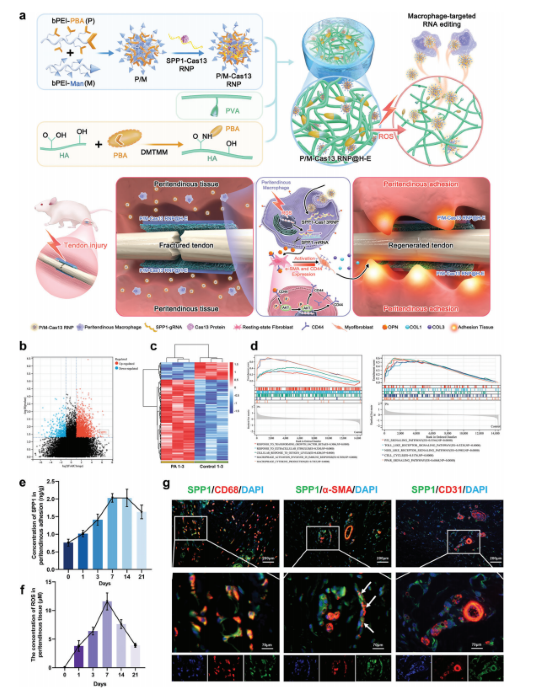
用于PA治疗的巨噬细胞免疫微环境激活mRNA编辑策略的示意图
Electrical stimulation of piezoelectric BaTiO3 coated Ti6Al4V scaffolds promotes anti-inflammatory polarization of macrophage and bone repair via MAPK/JNK inhibition and OXPHOS activation
脊髓损伤(SCI)是一种导致感觉自主神经和运动功能的永久性损害的严重致残性疾病。干细胞疗法,尤其是间充质干细胞(MSCs),在SCI治疗中展现出巨大潜力但其再生能力有限,这限制了其在组织再生中的应用。研究团队观察到ABPCs衍生的EVs(EVsABPC)可能携带促进组织再生的生物活性信号,因此他们从鹿角芽基祖细胞(ABPCs)中提取并修饰了细胞外囊泡(EVsABPC),并将其应用于脊髓损伤(SCI)的治疗研究。研究人员发现EVsABPC能够显著增强神经干细胞(NSCs)的增殖,促进轴突生长,减少神经元凋亡,并通过调节炎症反应将巨噬细胞从促炎的M1型极化为抗炎的M2型。此外,经过工程化改造的EVsABPC(通过激活细胞穿透肽修饰)能够更有效地靶向SCI损伤部位,显著改善神经再生和运动功能恢复。这些结果表明,EVsABPC是一种极具潜力的SCI治疗候选方案。

图解摘要
Generation of recombinant antibodies by mammalian expression system for detecting S-metolachlor in environmental waters
S-异丙甲草胺(S-MET)是我国生产和使用量最大的除草剂之一,其化学特性导致其可在土壤中持久存在以及容易通过淋溶和沉降污染地表水和地下水,最终影响植物生长和通过食物链危害人类生命健康。鉴于现有检测方法的局限性和对高效分析技术的迫切需求,该研究以S-metolachlor为对象,利用哺乳动物表达系统生成相关重组抗体。在成功表达抗体的基础上,成功建立了基于这些抗体的免疫分析方法,用于监测环境水样中的S-异丙甲草胺残留。icELISA结果显示,重组抗体的灵敏度和特异性与亲本单抗相似,可保持原有的生物学活性,对于江水、农田水和自来水中的S-MET,具有良好的准确性和重复性。
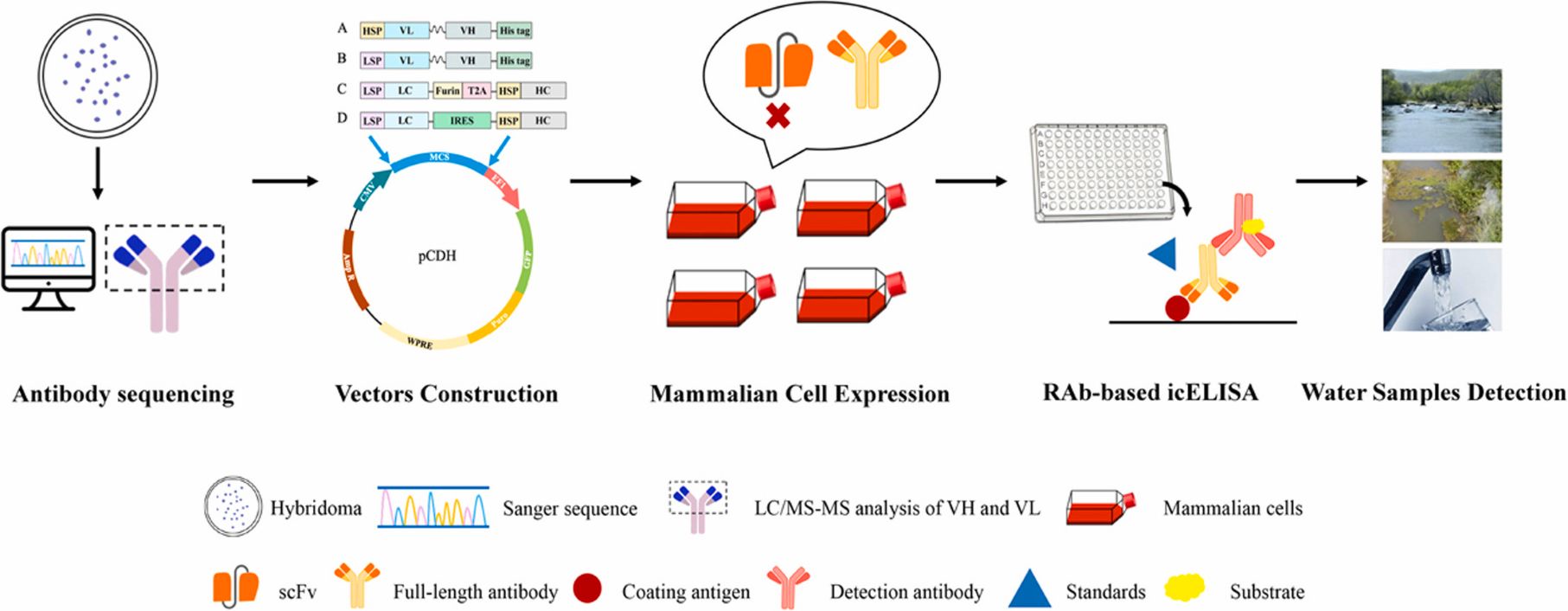
图解摘要
Dumbbell probe initiated multi-rolling circle amplification assisted CRISPR/Cas12a for highly sensitive detection of clinical microRNA
微小RNA(miRNA)是一类小的非编码RNA分子,通过与特定靶基因的信使RNA(mRNA)相互作用来调控基因表达。miRNA在多种疾病的发生、发展过程中扮演着重要角色,被认为是极具潜力的疾病生物标志物。该研究利用CRISPR/Cas12a开发了一种为DBmRCA的新型miRNA检测技术。该技术利用无连接酶的哑铃探针和高灵敏度的CRISPR/Cas12a信号输出策略,实现了在30分钟内对miRNA的高精度定量分析。研究团队通过临床样本验证了该技术的有效性,发现miR-200a和miR-126在肺癌组织中的表达水平显著降低,且该技术与传统方法结果一致。DBmRCA技术具有时间效率高、灵敏度强和操作流程简化等优点,为临床miRNA分析提供了一种可靠的工具,有望助力肺癌的早期诊断和治疗。
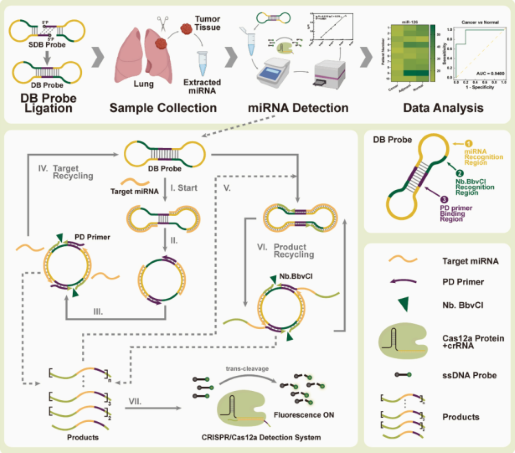
图解摘要







