 基因点突变细胞
基因点突变细胞
点突变细胞系是通过在目标基因特定位点引入单碱基替换或小范围的核苷酸插入/缺失,从而实现精确模拟疾病相关突变、研究基因功能和蛋白质结构的重要工具。相比于传统的基因编辑方式,点突变能够在不破坏整体基因结构的情况下实现精准修饰,为科研人员提供更贴近真实生理状态的细胞模型。
艾迪基因依托自主优化的 CRISPR/Cas9 与 Prime Editing 技术平台,结合高效 sgRNA 设计与严格的单克隆筛选体系,可为客户定制多种类型的点突变细胞系。我们的服务具备 编辑效率高达98%、脱靶率低至0.1%、验证全面 等特点,能够加速科研项目进展。点击查看100+点突变细胞现货→
服务优势
高效的编辑系统
高效pegRNA设计算法系统
增强型的Cas9n-RT编辑酶系统
高效的转染体系
高效的单克隆分选技术
专业的技术支持团队
点突变方法对比
| 特性 | 先导编辑 | 碱基编辑器 | HDR |
|---|---|---|---|
| 是否需要DSB | 否(单链nick) | 否 | 是 |
| 编辑类型 | 点突变、小插入/缺失 | 仅限C→T或A→G | 任意编辑(需供体) |
| 效率 | 高 | 高 | 低(<10%,依赖细胞分裂使用NHEJ抑制剂如SCR7,提升效率) |
| 适用细胞 | 分裂/非分裂细胞 | 分裂/非分裂细胞 | 主要分裂细胞 |
| 脱靶风险 | 低 | 中(bystander editing) | 高(NHEJ介导indels) |
服务类型
先导编辑器
工作原理
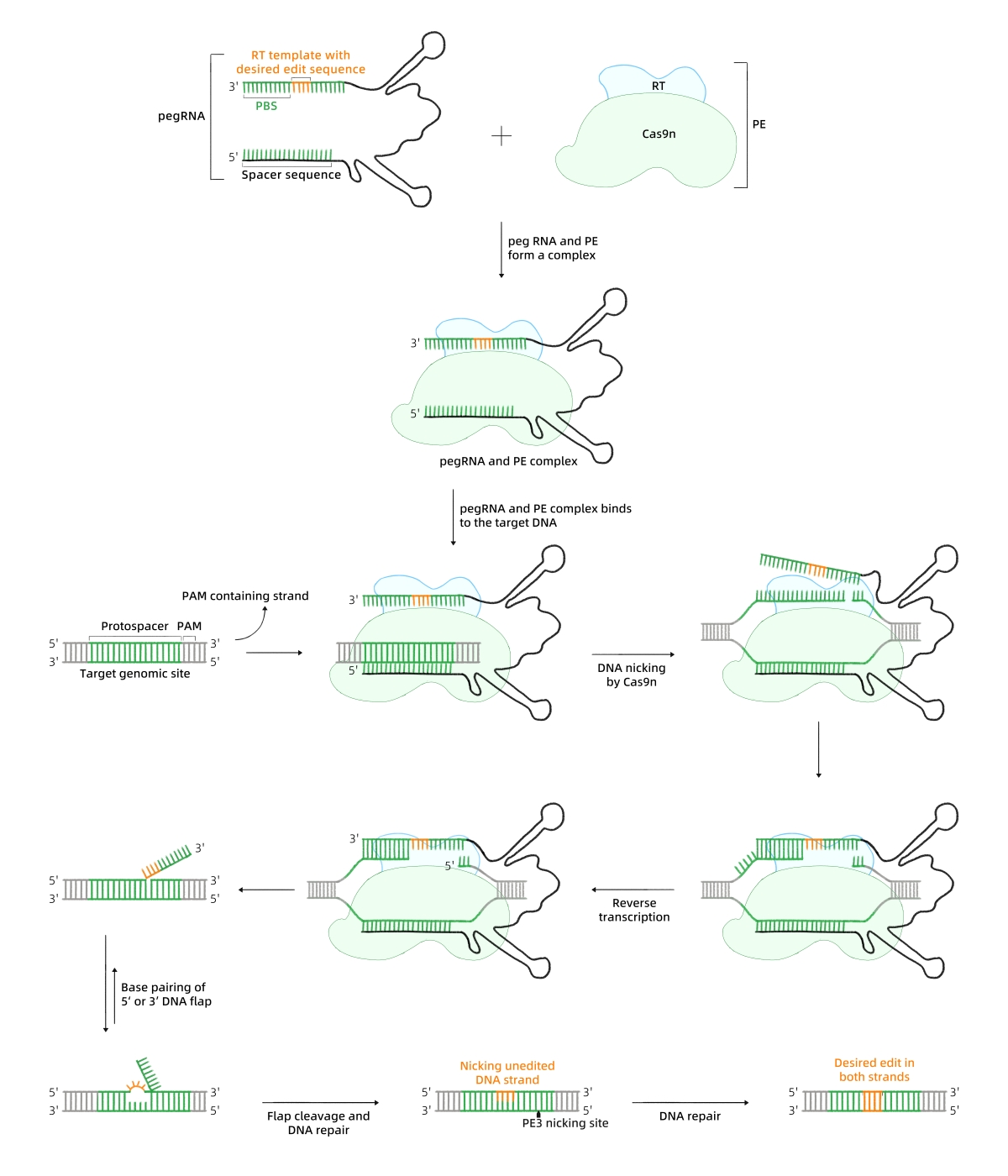
碱基编辑器
工作原理

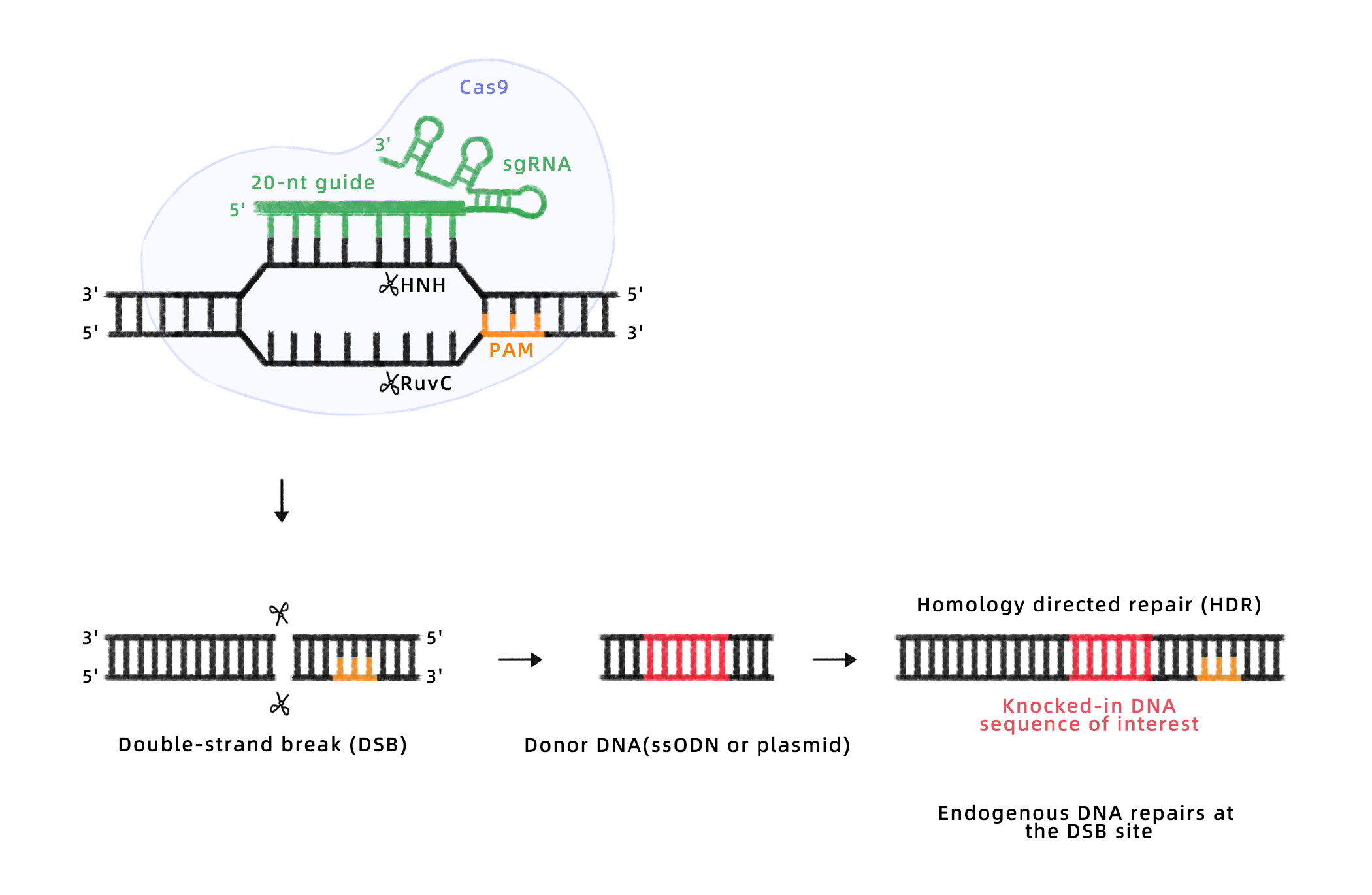
HDR
工作原理
成功案例
使用先导编辑在A549,K562,IPSC细胞中构建单碱基位点突变细胞系
| 细胞类型 | cell pool 编辑效率 | 测序峰图 | 挑选单克隆数量 | 单克隆纯合子数量 |
|---|---|---|---|---|
| A549 | 98% | WT:GAGTTGCGCATTAACAGTGGTGGGA MT:GAGTTGCGCATTAACGGTGGTGGGA  |
7 | 6 |
| K562 | 82% | WT:GTGGAGAAGCCCTTCGGGAGGGACC MT:GTGGAGAAGCCCCTCGGGAGGGACC 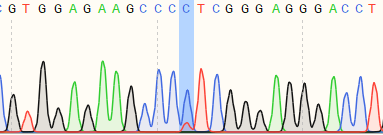 |
6 | 4 |
| IPSC | 60% | WT:AGGGAACCCCAAGTTGAACTTGGCTT MT:AGGGAACCCCAAGTTCAACTTGGCTT 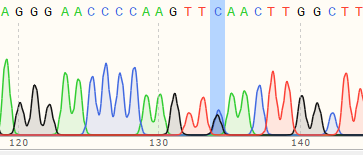 |
8 | 2 |
使用先导编辑在A549细胞中构建双位点突变细胞系
| 细胞类型 | cell pool 编辑效率 | 测序峰图 | 挑选单克隆数量 | 单克隆纯合子数量 |
|---|---|---|---|---|
| A549 | 56%及63% | WT:CAGTCCTCAAAATCTCCATCCCTGT MT:CAGTCCTCAAAACCCCCATCCCTGT 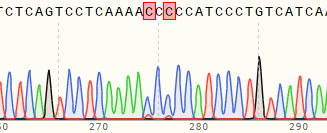 |
4 | 2 |
使用先导编辑在Hela细胞中构建碱基插入细胞系
| 细胞类型 | cell pool 编辑效率 | 测序峰图 | 挑选单克隆数量 | 单克隆纯合子数量 |
|---|---|---|---|---|
| Hela | 64% | WT:TCCGCTACCACCAATGCCTAATGCATTTGG MT:TCCGCTACCACCAATGCTAATAACTAATGCATTTGG  |
11 | 1 |
Advantage and Characteristic

Optimazied Strategy

Optimazied Strategy

Optimazied Strategy

Optimazied Strategy
参考文献
iPS细胞中实现多个二型糖尿病(T2D)风险SNVs的点突变
随着人类分子遗传学和基因组学的发展,数千个与常见疾病风险相关的基因位点被识别出来,这些位点通常包含多个候选变异。然而大多数与疾病相关的变异是非编码的,这使得识别这些变异背后的分子机制变得困难。CRISPR技术的发展为靶向基因组编辑提供了更精确的方法,特别是prime editing,它可以介导几乎任何单核苷酸替换。因此许多研究员期望利用prime editing研究特定基因变异功能相关性中的应用并在多能干细胞中生成等基因系列,以控制遗传背景,同时评估因果等位基因的剂量效应。 在该文章中,研究员们开发了一种高效的CRISPR prime editing技术,用于在诱导多能干细胞(iPSC)中生成携带杂合或纯合等位基因的细胞系,并对prime editing技术进行优化。接着选择了与2型糖尿病(T2D)风险相关的六个单核苷酸变异(SNVs)进行编辑,并针对每个位点从遗传背景不同的人类供体衍生的iPSCs中进行编辑,通过系列实验和对比评估编辑效率。研究结果表明,研究员们成功生成了27个编辑过的iPSC克隆,涵盖了6个与2型糖尿病或先天性高胰岛素血症(CHI)相关的SNVs。他们还发现,prime editing技术在iPSCs中的效率比在HEK293T细胞中更高。总的来说,这项研究展示了prime editing技术在生成特定遗传背景的iPSCs中的潜力,并为研究特定遗传变异对疾病影响提供了一个有力的工具。
通过冷冻电镜研究Prime editor复合体的作用过程推动Prime editin技术的迭代升级
关于Prime editor如何识别pegRNA并与目标DNA相互作用的分子机制尚不清楚,限制了对Prime editing过程的理解和进一步的优化。为解决这个问题,研究人员在多种状态下测定了Prime editor的冷冻电镜(cryo-EM)结构,为理解这一创新的基因组工程系统提供了结构框架。 研究人员使用冷冻电镜技术(cryo-EM)对Prime editor复合体在不同状态下的结构进行了分析,包括预启动、启动、延伸和终止状态,成功获得了Prime editor复合体在多个状态下的高分辨率结构,揭示了其在引导逆转录过程中的动态变化;基于结构信息,研究人员设计了pegRNA变体和Prime editor变体,并对M-MLV RT进行截短和融合,成功开发了一种更小尺寸的Prime editor变体(PECO-Mini),它在保持编辑效率的同时,提高了AAV载体的滴度和Prime editing效率,活性测试结果显示工程化后的Prime editor变体在体外具有与原始Prime editor相当的活性。该研究揭示了Prime editor复合体在不同工作状态下的结构特征,为理解其分子机制提供了重要信息。
通过截短RT酶提高经AAV递送的Prime editing编辑效率
Prime editing是一种新型的基于CRISPR的基因组编辑技术,它不需要双链DNA断裂或外源性供体模板DNA,展现出在生物医学研究和基因治疗方面的巨大潜力。尽管Prime editing技术具有多功能性和精确性,但它在不同类型的编辑、目标位点和细胞类型中的效率存在很大差异。因此,为了实现更广泛的应用,需要提高Prime editing的效率。 研究人员筛选了11种不同来源的RT变体,使用GenScript算法优化其人类密码子,发现PE蛋白表达水平提高了1.4倍;通过删除RNase H结构域和进一步缩短RT序列,创建多个截短的PECO变体,使Prime editor在保持编辑效率的同时长度减少了621bp;为了实现有效的双AAV传递PE,研究人员构建了基于不同Cas9分裂位点和intein的分裂PE系统,确定了Rma 573-574和674-675分裂位点,这两个位点与Rma intein结合使用时,显著提高AAV载体的滴度和Prime editor效率。通过工程化改造和优化,研究人员成功提高了Prime editing技术的编辑效率,并且解决了AAV载体大小限制的问题,为未来的基因治疗和生物医学研究提供了一个更加有效和实用的工具。
通过研究Prime editin作用机制推动Prime editin技术的迭代升级
该文章解析了prime editing技术中pegRNA引导逆转录的结构基础。研究通过高分辨率的结构分析,揭示了Prime Editor中的关键蛋白质,包括Cas9和逆转录酶的三维构象及其与pegRNA的相互作用。详细描述了pegRNA如何引导Prime Editor识别特定DNA序列并进行逆转录,将预定的基因序列插入目标位置。此外,研究还讨论了关键氨基酸残基在pegRNA结合和逆转录过程中的作用,解析了这些分子互动的精确机制。这一发现不仅深化了我们对Prime Editing机制的理解,还为优化和改进该技术提供了宝贵的结构信息,推动其在基因治疗等领域的应用。
在造血干细胞和祖细胞(HSPCs)实现HBBS基因的点突变
镰状细胞病(Sickle-cell disease, SCD)是一种由β-珠蛋白基因(HBB)中的一个A·T到T·A的点突变引起的常染色体隐性遗传病。目前,美国食品药品监督管理局(FDA)批准的唯一治愈SCD的方法是同种异体造血干细胞移植。然而,大多数患者缺乏理想的供体,并且该手术会导致严重的毒性。通过校正患者自身的造血干细胞(HSCs),可以绕过免疫并发症,并消除对组织相容性供体的需求。目前,已有一些关于使用Cas9核酸酶启动的同源定向修复(HDR)和腺相关病毒类型6(AAV6)递送的DNA模板来校正SCD突变的临床试验研究正在进行中。 在该文章中,研究员们利用优化的prime editing系统对SCD患者造血干细胞和祖细胞(HSPCs)进行体外校正,通过电穿孔将PEmax mRNA与合成的epegRNA和切割sgRNA结合使用,成功将SCD等位基因(HBBS)校正回野生型(HBBA),校正频率在15%到41%之间。之后,研究员们将经过启动编辑的HSPCs移植到免疫缺陷的小鼠体内,7周后,编辑的HSPCs在小鼠骨髓中维持了HBBA水平,并显示出与未编辑的健康供体HSPCs相似的植入频率、造血分化和谱系成熟。治疗效果评估发现,在移植后的小鼠中,平均42%的人红细胞前体和网织红细胞表达了HBBA,超过了预测的治疗益处水平。基因特异性分析也表明启动编辑系统具有高度的目标DNA特异性。最终研究结果证实了该技术手段的安全性和效率,具有长期效果和多克隆性。总结来说,这项研究展示了prime editing技术在治疗SCD中的潜力,证明了其在提高治疗效果和降低非目标编辑风险方面的有效性。
精选客户文章
Deep whole-genome analysis of 494 hepatocellular carcinomas
全球超过一半的肝细胞癌(HCC)病例发生在中国,但目前针对中国人群中乙型肝炎病毒(HBV)相关HCC的全基因组分析研究非常有限。为了突破这种限制,研究人员启动了“中国肝癌图谱项目”(CLCA),旨在对中国人群中的HCC进行大规模的全基因组分析以理解其独特的发病机制和进化过程。该项目对494例HCC肿瘤样本进行了深度全基因组测序(平均测序深度为120×),并分析了匹配的对照血液样本,揭示了HBV相关HCC的详细基因组特征。研究发现,除了已知的编码区驱动基因(如TP53和CTNNB1)外,还存在6个新的编码区驱动基因(包括FGA)和31个非编码区驱动基因。此外,研究还揭示5种新的突变特征(包括SBS_H8),以及HBV整合形成细胞外环状DNA(ecDNA)的现象,这些ecDNA可导致癌基因扩增和表达增加。通过功能验证实验,研究人员证实了FGA、PPP1R12B和KCNJ12等基因的突变能够显著影响HCC细胞的增殖、迁移和侵袭能力。这项研究结果不仅丰富了人们对HCC基因组学的理解,也为HCC的诊断和治疗提供了新的潜在靶点。
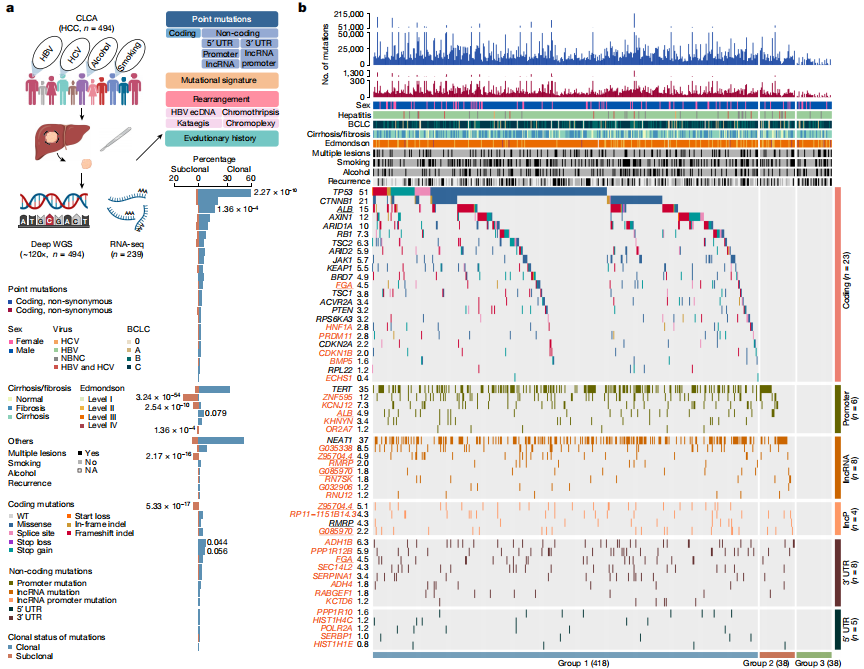
候选驱动因子概况
Targeted Macrophage CRISPR-Cas13 mRNA Editing in Immunotherapy for Tendon Injury
肌腱损伤急性炎症期中,巨噬细胞过度激活会导致编码骨桥蛋白OPN的SPP1过表达,影响组织再生。CRISPR-Cas13由于具有RNA编辑和快速降解的能力,在组织修复方面具有巨大潜力,但缺乏合适有效的递送方法。对此,研究人员系统筛选了针对巨噬细胞的阳离子聚合物,开发了一种能够高效递送Cas13核糖核蛋白复合物(Cas13 RNP)进入巨噬细胞的纳米簇载体。通过反应性氧种(ROS)响应性释放机制,该系统能够在肌腱损伤的急性炎症微环境中特异性抑制巨噬细胞中SPP1的过表达。实验结果表明,这种靶向策略显著减少了损伤诱导的SPP1产生巨噬细胞的出现,降低了成纤维细胞的激活,并减轻了肌腱周围的粘连形成。此外,该研究还揭示了SPP1通过CD44/AKT信号通路促进成纤维细胞活化和迁移的机制,并通过抑制这一通路有效缓解了肌腱损伤后的粘连问题。
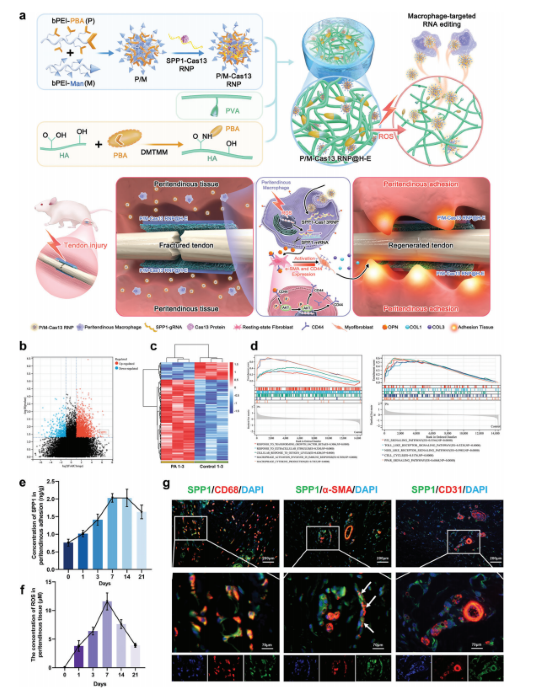
用于PA治疗的巨噬细胞免疫微环境激活mRNA编辑策略的示意图
Electrical stimulation of piezoelectric BaTiO3 coated Ti6Al4V scaffolds promotes anti-inflammatory polarization of macrophage and bone repair via MAPK/JNK inhibition and OXPHOS activation
脊髓损伤(SCI)是一种导致感觉自主神经和运动功能的永久性损害的严重致残性疾病。干细胞疗法,尤其是间充质干细胞(MSCs),在SCI治疗中展现出巨大潜力但其再生能力有限,这限制了其在组织再生中的应用。研究团队观察到ABPCs衍生的EVs(EVsABPC)可能携带促进组织再生的生物活性信号,因此他们从鹿角芽基祖细胞(ABPCs)中提取并修饰了细胞外囊泡(EVsABPC),并将其应用于脊髓损伤(SCI)的治疗研究。研究人员发现EVsABPC能够显著增强神经干细胞(NSCs)的增殖,促进轴突生长,减少神经元凋亡,并通过调节炎症反应将巨噬细胞从促炎的M1型极化为抗炎的M2型。此外,经过工程化改造的EVsABPC(通过激活细胞穿透肽修饰)能够更有效地靶向SCI损伤部位,显著改善神经再生和运动功能恢复。这些结果表明,EVsABPC是一种极具潜力的SCI治疗候选方案。

图解摘要
Generation of recombinant antibodies by mammalian expression system for detecting S-metolachlor in environmental waters
S-异丙甲草胺(S-MET)是我国生产和使用量最大的除草剂之一,其化学特性导致其可在土壤中持久存在以及容易通过淋溶和沉降污染地表水和地下水,最终影响植物生长和通过食物链危害人类生命健康。鉴于现有检测方法的局限性和对高效分析技术的迫切需求,该研究以S-metolachlor为对象,利用哺乳动物表达系统生成相关重组抗体。在成功表达抗体的基础上,成功建立了基于这些抗体的免疫分析方法,用于监测环境水样中的S-异丙甲草胺残留。icELISA结果显示,重组抗体的灵敏度和特异性与亲本单抗相似,可保持原有的生物学活性,对于江水、农田水和自来水中的S-MET,具有良好的准确性和重复性。
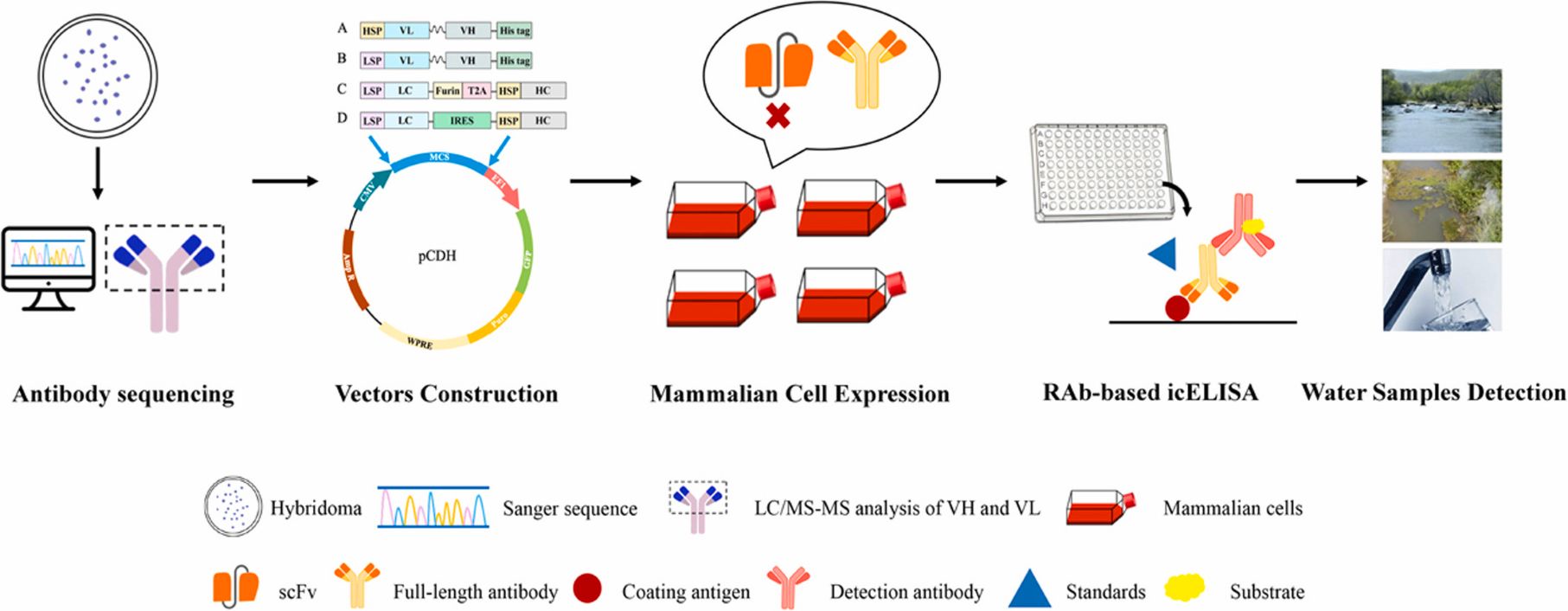
图解摘要
Dumbbell probe initiated multi-rolling circle amplification assisted CRISPR/Cas12a for highly sensitive detection of clinical microRNA
微小RNA(miRNA)是一类小的非编码RNA分子,通过与特定靶基因的信使RNA(mRNA)相互作用来调控基因表达。miRNA在多种疾病的发生、发展过程中扮演着重要角色,被认为是极具潜力的疾病生物标志物。该研究利用CRISPR/Cas12a开发了一种为DBmRCA的新型miRNA检测技术。该技术利用无连接酶的哑铃探针和高灵敏度的CRISPR/Cas12a信号输出策略,实现了在30分钟内对miRNA的高精度定量分析。研究团队通过临床样本验证了该技术的有效性,发现miR-200a和miR-126在肺癌组织中的表达水平显著降低,且该技术与传统方法结果一致。DBmRCA技术具有时间效率高、灵敏度强和操作流程简化等优点,为临床miRNA分析提供了一种可靠的工具,有望助力肺癌的早期诊断和治疗。
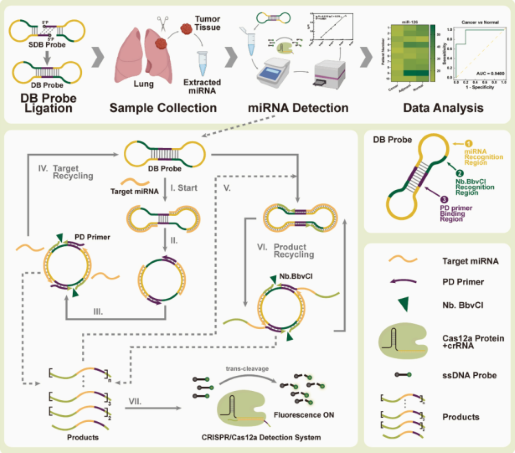
图解摘要






