【文献解读】CRISPR基因敲除ERAP1为优化肿瘤免疫疗法提供新思路

神经母细胞瘤(NB)是常见的儿科肿瘤之一,通常发生在儿童的交感神经系统,特别是肾上腺中。尽管一些早期NB病例可以通过手术和化疗治愈,但大多数晚期病例由于肿瘤的生长特性和对常规治疗的抵抗性,导致治疗效果不理想。现如今在癌症的治疗中,免疫治疗法已经在成人癌症的治疗中展现出了显著的效果,其中免疫检查点抑制(ICI)的应用最为广泛。然而研究人员发现,NB的肿瘤细胞通常免疫原性较低,缺乏有效抗原刺激免疫系统,这使得这些肿瘤细胞对免疫检查点抑制(ICI)等免疫疗法的响应并不理想。这一特性使NB成为目前免疫治疗领域中亟待突破的挑战之一。
为了解决这个问题,研究人员使用CRISPR/Cas9基因敲除技术对小鼠肿瘤细胞中的内质网氨肽酶1(ERAP1)基因进行了敲除。ERAP1的功能是修剪抗原肽,帮助其与主要组织相容性复合体I类分子(MHC I)结合,从而增强T细胞对肿瘤的识别。将ERAP1敲除后,细胞产生了新抗原,显著提升了其免疫敏感性。为了进一步进行验证,研究人员在敲除细胞中加入了组蛋白去乙酰化酶(HDAC)抑制剂Entinostat,观察到MHC I和程序性死亡配体-1(PD-L1)表达增加,T细胞对肿瘤的攻击力明显增强。这表明ERAP1敲除结合Entinostat和程序性死亡蛋白-1(PD-1)阻断疗法显著抑制了肿瘤生长,延长了小鼠细胞的生存期,为人类非免疫原性肿瘤的免疫治疗提供了新思路。该研究发表在Journal of Experimental & Clinical Cancer Research,题目为“Combining ERAP1 silencing and entinostat therapy to overcome resistance to cancer immunotherapy in neuroblastoma”。

原文链接:https://doi.org/10.1186/s13046-024-03180-y
一、ERAP1的下调对9464D细胞表面MHC I类分子表达没有显著影响
首先,研究人员采用CRISPR/Cas9基因编辑技术,通过设计两种单导向RNA(sgRNAs)靶向ERAP1基因的不同外显子区域,对小鼠NB细胞系9464D中的ERAP1进行了敲除,并使用Western blot和基因测序技术确认了敲除成功,该基因的蛋白表达被完全抑制。为了分析其在抗原加工与呈递(APP)通路中的具体作用,特别是其是否影响MHC I类分子的表面表达,研究人员对ERAP1敲除细胞和对照细胞进行了干扰素-γ(IFNγ)处理。IFNγ是一种可诱导MHC I表达的分子。结果显示,敲除ERAP1的9464D细胞在MHC I类分子的表达上未发生显著变化,并且敲除细胞和对照组细胞在IFNγ处理后的MHC I恢复水平上基本一致,表明ERAP1的缺失并不会影响MHC I的诱导表达。此外,通过检测APP通路的其他成分(如TAPBP和β2微球蛋白)以及IFNγ信号通路的关键成分(如IRF1、IRF2和STAT1)的表达水平,结果显示ERAP1的缺失对这些成分的表达造成并没有明显的影响。这些结果表明尽管ERAP1在抗原修饰中具有作用,但其缺失不会显著改变MHC I分子的表面表达或干扰抗原呈递过程,证明ERAP1的抑制或敲除不会妨碍免疫系统识别和攻击肿瘤细胞的能力。
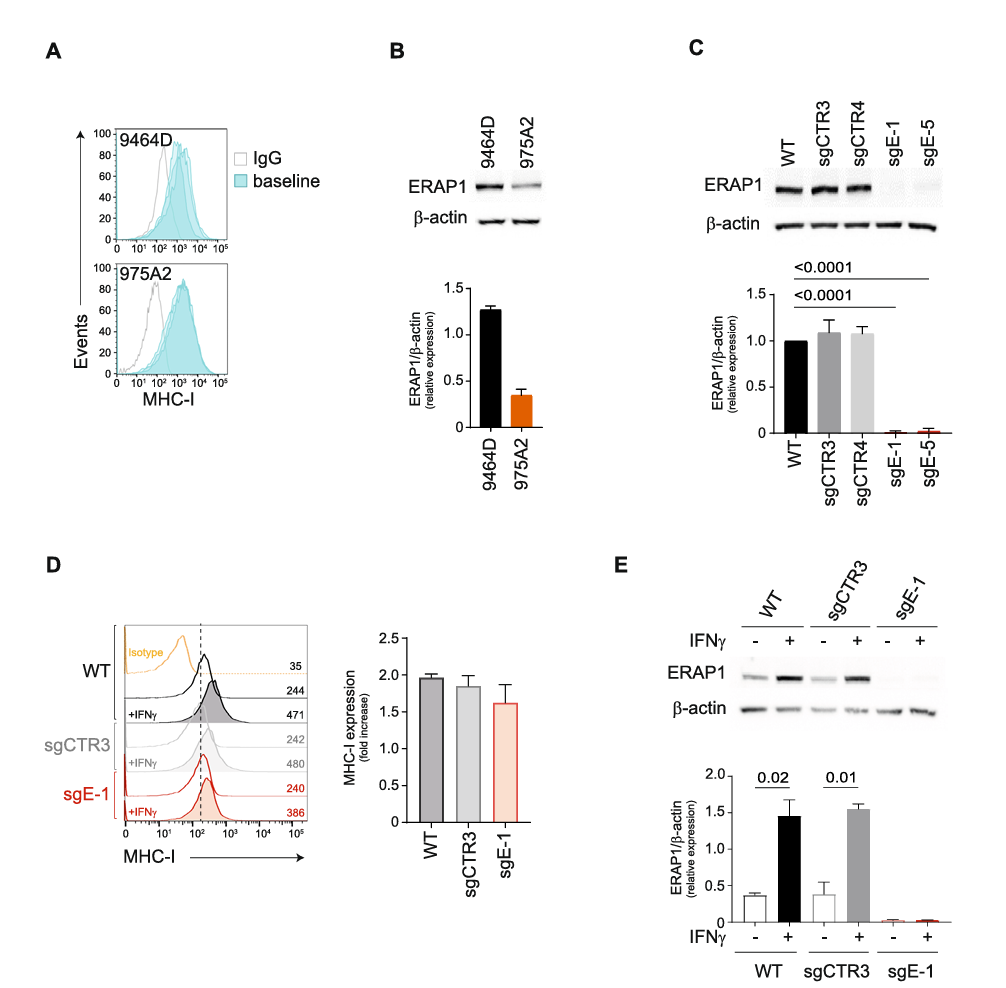
图 1 ERAP1的抑制不影响9464D细胞表面MHC I类分子的表达
二、ERAP1的抑制使9464D细胞更易被免疫细胞裂解
为了研究ERAP1的敲除对肿瘤细胞的影响,研究人员将敲除ERAP1基因的9464D细胞株命名为sgE-1,并创制了引入不靶向任何基因的sgRNA处理的9464D另一个细胞株sgCTR3作为对照,以确保实验组和对照组的基因编辑过程一致。根据已有研究,ERAP1的沉默会引起的免疫肽组变化,进而影响T细胞和NK细胞介导的抗肿瘤反应。为了评估sgE-1细胞在激活免疫细胞方面的能力,研究人员将经IFNγ处理和未经处理的sgCTR3和sgE-1细胞系及来源于野生型9464D肿瘤小鼠的脾细胞分别进行了共培养。结果表明,在共培养2小时后,相比sgCTR3,sgE-1吸引了更多的CD3+ T细胞、CD8+ T细胞、NK细胞和NKT细胞。
进一步对脾细胞与sgE-1细胞共培养上清液的蛋白质阵列分析显示,与sgCTR3相比,免疫细胞对于相关的趋化因子如CX3CL1和CCL5的吸引增加了两倍以上。此外,sgE-1细胞与脾细胞共培养18小时后,与对照细胞相比,更多的CD8+ T细胞和NK细胞被激活,并且激活标志物的表达显著增加。共培养7小时后sgE-1细胞中caspase 3/7阳性细胞增加。接着进行共培养到24小时后,存活的sgE-1细胞显著少于sgCTR3。这些数据表明,ERAP1的敲除促进了IFNγ释放增加以及T细胞和NK细胞的吸引和激活,使得肿瘤细胞更易被这些免疫细胞裂解清除。

图 2 ERAP1的抑制使9464D细胞更易被免疫细胞裂解
三、ERAP1的缺失在体内抑制9464D肿瘤生长方面效果有限
研究人员将敲除ERAP1的sgE-1细胞和对照sgCTR3细胞分别植入同系C57BL/6小鼠的左侧腹部,观察肿瘤生长情况并持续监测肿瘤体积变化。结果显示,尽管ERAP1缺失在体外实验中增强了免疫细胞对肿瘤的攻击性,但在体内并不足以有效控制9464D肿瘤的生长。对肿瘤组织中不同免疫细胞群体的比例进行了多色流式细胞术分析,并没有发现免疫细胞浸润差异。这一现象可能是由于9464D肿瘤中MHC I类分子表达水平较低,使得ERAP1敲除所引发的免疫反应未能充分发挥作用,导致其对体内肿瘤生长的抑制效果有限。这一结果暗示,仅靠ERAP1的敲除并不足以激发足够的免疫反应来控制神经母细胞瘤的生长,还可能需要其他手段来进一步提升肿瘤的免疫原性。

图 3 ERAP1的抑制不影响9464D肿瘤的生长和免疫环境
四、ERAP1的缺失影响entinostat诱导的9464D细胞的MHC I类分子表达及其免疫肽组
通过使用不同浓度的entinostat处理9464D细胞,研究者们发现2μM浓度的entinostat在48小时内可使MHC I类分子表面表达增加至少两倍,并保持细胞活性。进一步的研究结果显示,entinostat能够在对照组sgCTR3和敲除组sgE-1细胞中均诱导MHC I类分子的表达,但缺乏ERAP1的sgE-1细胞中表达水平显著降低。此外,非经典MHC I类分子Qa-1b的表达也在sgCTR3和sgE-1细胞中被诱导,但在sgE-1中的效果较弱,这说明ERAP1可能参与Qa-1b配体生成。然而RAE1和CD86等不与肽结合的分子在sgCTR3和sgE-1细胞中的表达均未受ERAP1缺失的影响,这表明ERAP1对MHC I类分子的作用具有特异性。
为进一步探究ERAP1对免疫肽组的影响,研究人员对经entinostat处理的sgE-1和sgCTR3细胞进行了质谱分析。通过从H-2Kb和H-2Db分子上纯化并洗脱肽段,鉴定了3419个(8-14个氨基酸)和7776个(9-14个氨基酸)肽段。使用NetMHC-4.0工具预测这些肽段与H-2Kb和H-2Db的结合亲和力,结果显示在sgE-1细胞中,H-2Kb和H-2Db分子的典型肽段长度显著减少,而更长的肽段增加。然而这种差异在sgCTR3和sgE-1共享的肽段中未观察到,该结果进一步支持了ERAP1缺失产生独特免疫肽组的结论。此外,对肽段序列中保守氨基酸分布的分析显示,ERAP1缺失对H-2Kb和H-2Db结合的典型8肽和9肽的组成产生了影响,尤其是H-2Kb结合肽段的P5位点的保守氨基酸模式完全丧失。这些结果表明,H-2Kb和H-2Db呈递的免疫肽组的典型长度和组成对ERAP1依赖性强,在ERAP1敲除细胞中呈现出独特的免疫肽组。
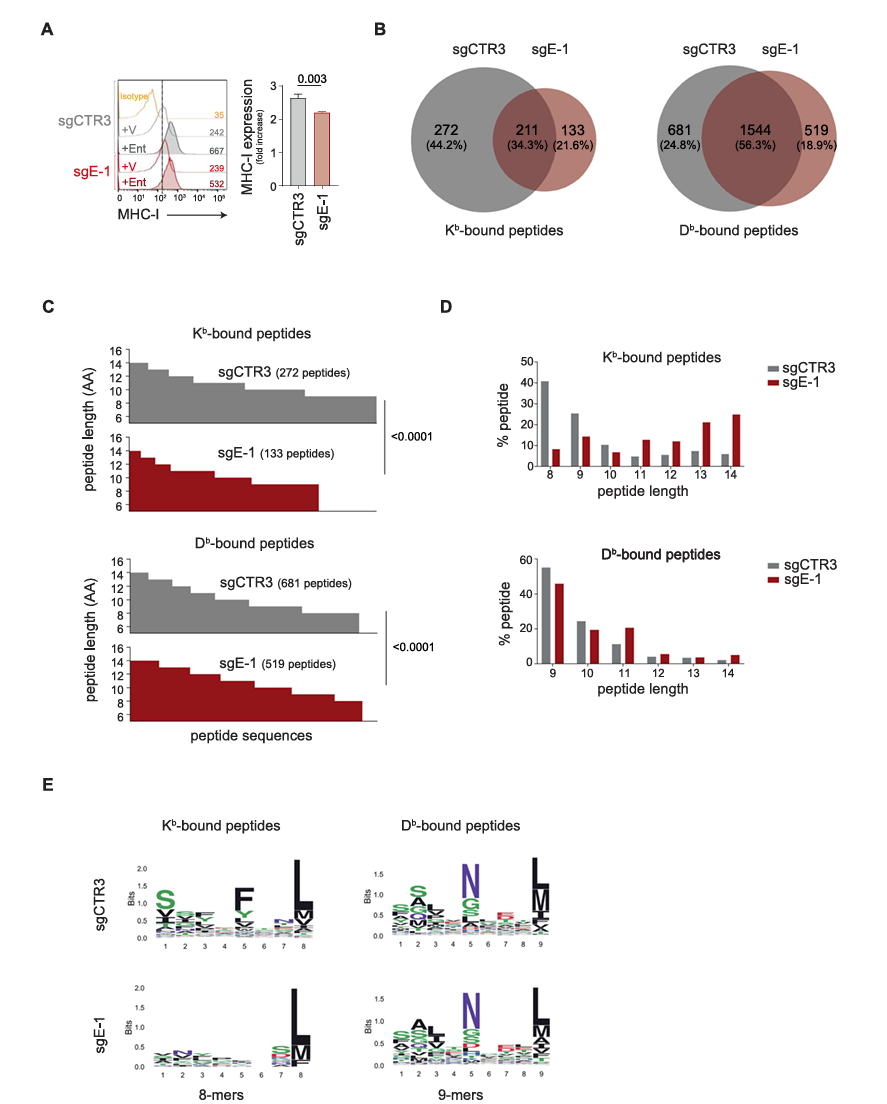
图4 ERAP1的抑制影响经entinostat处理的9464D细胞的MHC I类分子表面表达及其免疫肽组
五、ERAP1的缺失使得entinostat治疗过程中的肿瘤免疫微环境重新编程了,延缓了肿瘤的进展
为评估entinostat联合ERAP1沉默的体内抗肿瘤效果,研究人员将sgCTR3和sgE-1细胞分别皮下注射到C57BL/6小鼠的腹部。结果显示,entinostat显著抑制了sgE-1肿瘤的进展,但对sgCTR3肿瘤无显著影响,肿瘤进展的减缓显著延长了宿主的生存期。在注射后46天,所有对照小鼠已死亡,而60%的sgE-1肿瘤负载小鼠仍然存活,表明ERAP1缺失使9464D肿瘤对entinostat治疗产生响应。与体外实验相似,entinostat处理显著增加了MHC I类分子的表面表达水平。不仅如此,Entinostat还将NB细胞从肾上腺(ADR)表型转变为更具免疫原性的间充质(MES)表型。免疫组化分析显示,entinostat处理的肿瘤中MES标志物SOX9的表达增加,并与ERAP1的表达无关。此外,对治疗10天后的肿瘤中不同免疫细胞亚群进行分析,发现entinostat处理的sgE-1肿瘤中免疫浸润显著增加,尤其是TILs、CD8+ T细胞和CD4+ T细胞亚群。尽管NK细胞的增加不显著,但整体的免疫细胞浸润得到增强。同时,荧光分析也证实了这些结果,并显示entinostat处理的sgE-1肿瘤中IFNγ和颗粒酶B表达的CD8+ T细胞及表达IFNγ的NK细胞显著增加。这些结果表明ERAP1缺失联合entinostat治疗能够促进炎性T细胞表型的形成,从而实现对神经母细胞瘤(NB)生长的控制。
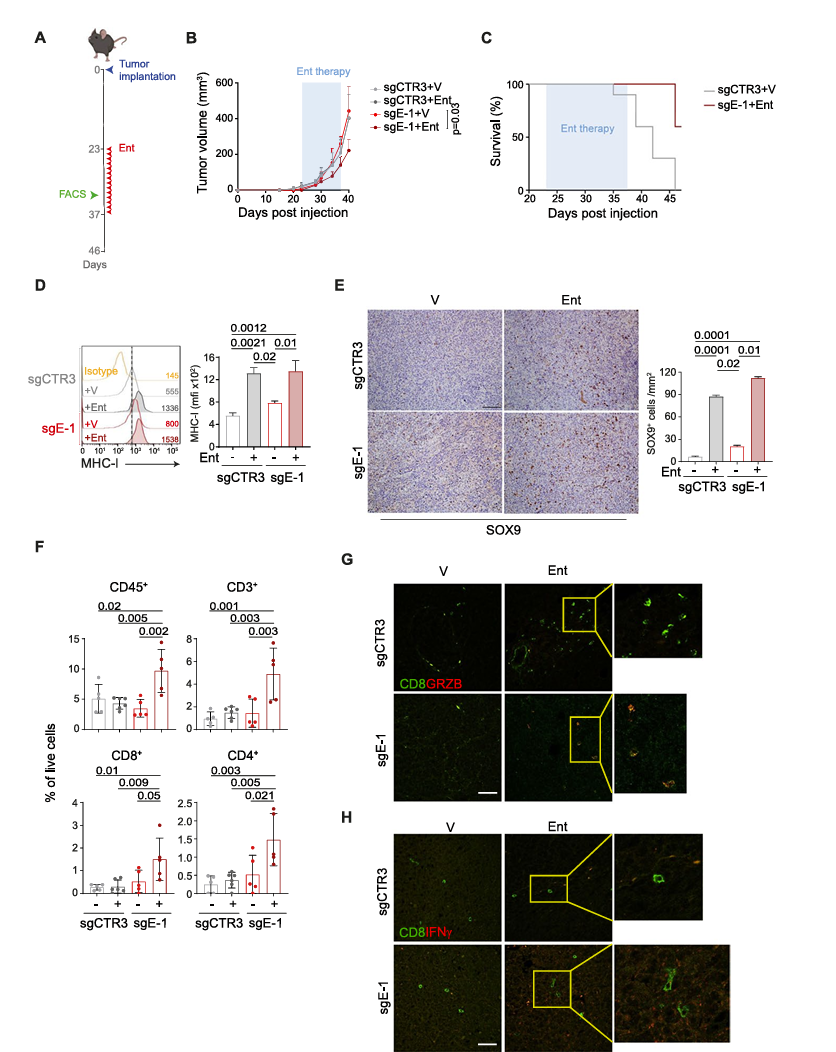
图5 ERAP1抑制联合entinostat治疗延缓了9464D肿瘤的生长并重塑了肿瘤内的免疫浸润
六、ERAP1缺失联合entinostat和PD-1阻断治疗有效控制肿瘤生长并延长宿主生存期
先前已有研究表明,entinostat可在多种肿瘤模型中诱导PD-L1表达。在本研究中,entinostat处理后的9464D细胞在体内和体外均表现出PD-L1表达增加,与ERAP1表达水平无关。为了测试entinostat是否能提高PD-1阻断疗效,研究者们将sgE-1和sgCTR3细胞注射到C57BL/6小鼠体内,待肿瘤生长至100 mm³后,将小鼠分为四组:对照组、entinostat单独组、PD-1阻断组以及entinostat和PD-1阻断联合组。结果表明,entinostat对ERAP1缺失的肿瘤疗效更显著,而单独使用PD-1阻断疗法无论是否缺失ERAP1都没有明显的效果。对于小鼠的存活能力进行分析,entinostat联合PD-1阻断在sgE-1肿瘤中的效果明显优于其他治疗方案。对sgCTR3肿瘤小鼠来说,联合治疗的效果与单独使用entinostat相似,40%的小鼠存活;而在sgE-1肿瘤小鼠中,联合治疗显著提高了生存率,46天后所有接受联合治疗的sgE-1肿瘤小鼠仍然存活,相比之下仅有57%接受entinostat单独治疗的小鼠存活。此外,免疫组化分析显示,接受联合治疗的sgE-1肿瘤中CD8+ T细胞浸润明显增加。这些结果表明ERAP1的缺失在增强entinostat和PD-1阻断联合治疗的抗肿瘤效果方面发挥了重要作用,使原本对PD-1阻断无反应的9464D肿瘤模型表现出明显的治疗响应。
总的来说,以上的结果表明ERAP1在肿瘤免疫调控中具有关键作用,对其进行基因敲除能够增强神经母细胞瘤对免疫疗法的响应性。另外,ERAP1的抑制不仅可以通过上调MHC I类分子和非经典MHC分子的表达来增加肿瘤的免疫原性,还能与entinostat和PD-1阻断疗法联合作用,有效延缓肿瘤生长,显著延长宿主的生存时间。这些发现为非免疫原性肿瘤(如神经母细胞瘤)的免疫治疗提供了新的策略,表明ERAP1可能是未来肿瘤免疫治疗中的潜在靶点,通过调控其活性可以提高肿瘤对免疫疗法的敏感性和治疗效果。
艾迪基因创新研发了高效的基因敲除技术,采用升级的CRISPR/Cas9系统提供基因定点敲除定制服务。十几年的基因编辑经验总结出来最优gRNA和同源臂设计策略,艾迪基因提供的基因定点敲除服务具有更高的阳性率和更广的基因位点适用性!
近期资讯
1.【一周时讯】 CRISPR/Cas9基因编辑:联合ERAP1敲除,新策略破解神经母细胞瘤的免疫治疗耐药性
2.【文献解读】 CRISPR检测新突破:CrisprAIE引领精准检测新潮流
3.【一周时讯】新算法模型gRNA设计:驱动CRISPR检测灵敏度升级!
联系我们
18102225074(微信同号)
market@edgene.cn


 Login
Login










Comment (4)